- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

世界肺炎日丨流感季节,警惕肺炎
一、前言
呼吸系统是人体与外界空气进行气体交换的一系列器官的总称,包括鼻、咽、喉、气管、支气管,及由大量的肺泡、血管、淋巴管、神经构成的肺、胸膜等组织。其中,肺是人体呼吸系统中最重要的器官,承载着呼吸调节功能、免疫功能、肺循环功能、造血功能等多种重要的功能。肺位于胸腔,左右各一,覆盖于心之上。正常的肺呈浅红色,左右各有肺叶,左二右三,右肺可以分为上、中、下三叶,左肺则仅有上、下两叶。
近年来,呼吸系统相关疾病的发病率和死亡率急剧增高,已成为全球主要公共卫生问题之一。吸烟、创伤、吸入粉尘和有害气体、病毒、细菌等感染以及接触过敏原等多种因素都引起气道和肺部结构出现功能障碍,引发多种类型疾病发生,诸如支气管哮喘、急性肺损伤、慢性阻塞性肺病、肺纤维化、肺动脉高压等。
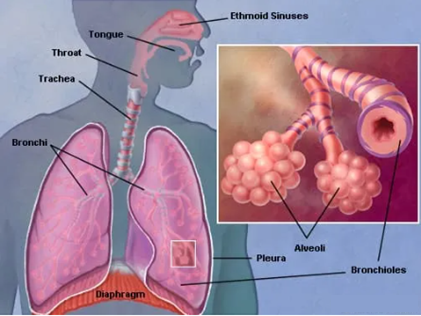
图1 人体肺部解剖学图片(https://www.webmd.com/lung/picture-of-the-lung)
1.1呼吸系统重大疾病动物模型介绍
建立与人类呼吸系统疾病病理生理及临床变化高度拟合的实验动物模型是了解人类疾病和测试潜在药物治疗的实用工具,是临床前研究和推进现代医学的基石。下面分别为大家介绍几种常见呼吸系统重大疾病动物模型。
01 哮喘模型
支气管哮喘(Bronchial Asthma)简称哮喘,是一种常见的气道疾病,影响着全球3亿多人,且患病率持续增加,特别是儿童患有过敏性哮喘的比例持续增加。根据哮喘全球防治创议(Global Initiative in Asthma,GINA)发布的GINA全球哮喘处理和预防策略,哮喘被定义为“一种异质性疾病,常以慢性气道炎症为特征,表现为随时间变化和加剧的呼吸系统症状,如喘息、气短、胸闷和咳嗽,同时可有持续存在的呼气气流受限”。
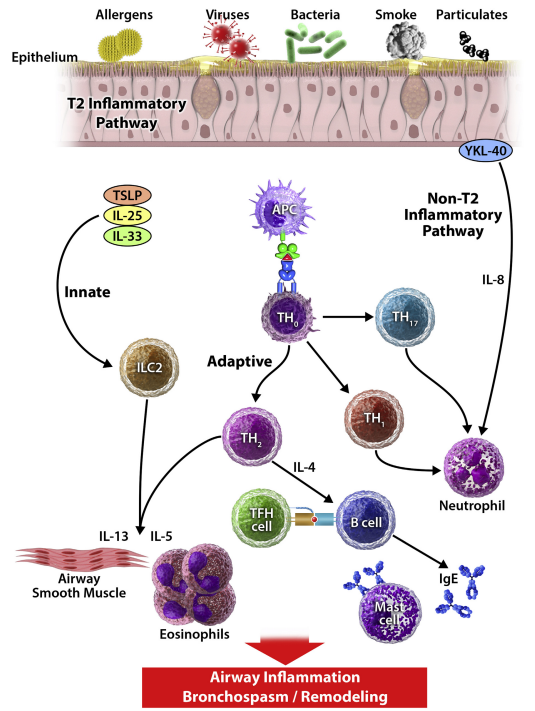
图2 哮喘患者相关炎症通路(doi: 10.1016/j.jaci.2019.05.031.)
过敏性哮喘动物模型是目前研究最广泛,也是与人类哮喘病理生理机制最接近的哮喘模型类型。常用过敏性哮喘模型的建立分为两个阶段,第 1 阶段是致敏,抗原刺激 B 细胞后,产生 IgE 可与肥大细胞和嗜碱性粒细胞表面高亲和受体 FcεR1 结合,使动物致敏。第 2 阶段是激发,再次接触到抗原后,气道中的效应细胞(肥大细胞和嗜碱性粒细胞)将通过 FcεR1 激活,迅速引发超敏反应。过敏性哮喘的造模剂有卵清蛋白、屋尘螨提取物、粉尘螨提取物、葎草花粉粗浸液、豚草、烟曲霉提取物、内毒素等,其中卵清蛋白(OVA)致敏研究最充分,模型最成熟。
方法:常用23 d OVA 造模法,5~7 周龄BALB/c 小鼠第 1 天和第 14 天腹腔注射混合 1% 氢氧化铝(Al(OH)3)的 OVA诱发致敏;第21、22和23天,以1%~2%浓度的OVA滴鼻或雾化吸入激发。
02 急性肺损伤模型
急性肺损伤(acute lung injury,ALI)是1994年由美国-欧洲共识会议委员会首次提出,由多种直接或间接因素(包括但不限于感染、创伤、中毒、休克、肺炎、输血、免疫反应等)导致氧合指数(oxygenation index,OI)≤ 300 mmHg(1 mmHg=0.133 kPa)的概念。ALI以快速肺泡损伤、严重低氧血症、血管通透性增加以及不可控的炎症反应为病理表现,严重可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是临床上导致多器官衰竭和高死亡率的主要原因之一。
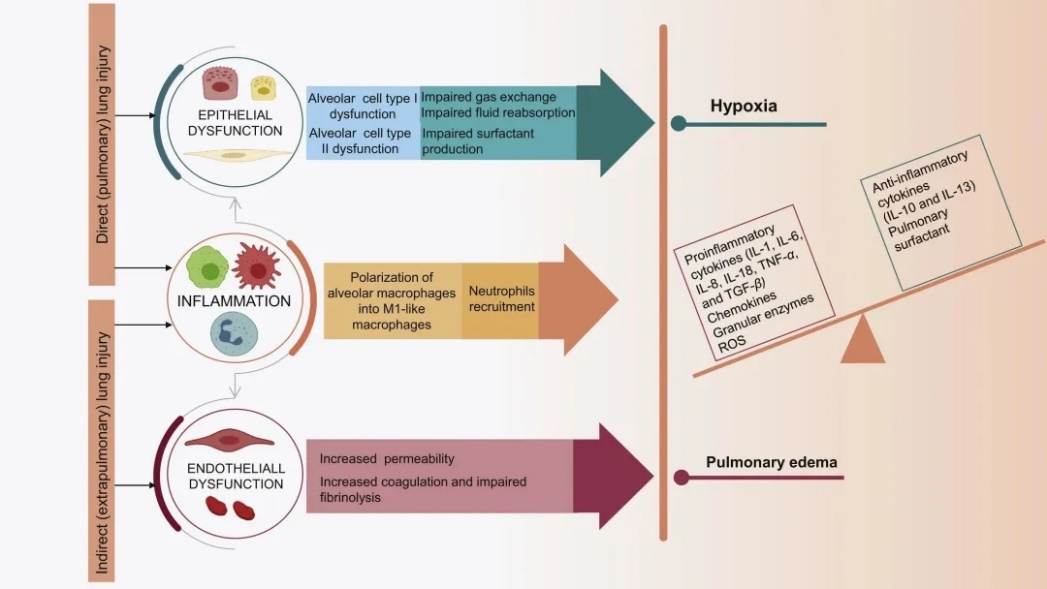
图3 ALI/ARDS的发病机制(doi.org/10.1016/j.apsb.2021.08.009)
ALI动物模型是基于与人类ARDS相关的一些临床疾病构建的,比如细菌感染、缺血再灌注损伤、创伤、腹膜炎等疾病,其中高潮气量或高峰值吸气压力的机械通气、肺部或全身内毒素给药以及盲肠结扎后穿刺法都是最常用的动物肺损伤模型。其中以脂多糖(lipopolysaccharides,LPS)诱导的ALI模型研究应用最为广泛。
方法:选用 6-8周龄雄性Balb/c小鼠,通过吸入、腹腔注射、静脉注射等方式给予LPS(3~5 mg/kg)。LPS是革兰氏阴性细菌外膜的主要成分,机体受到LPS刺激后出现肺水肿和炎性细胞浸润,炎性细胞浸润进一步导致活性氧和炎症因子的释放,最终出现急性肺损伤病变。
03 肺纤维化模型
肺纤维化(pulmonary fibrosis,PF)疾病是一种病因不明的典型间质性肺病,是许多慢性肺疾病的共同结局,其病理特征为长期肺部炎症导致肺泡持续性损伤以及细胞外基质(ECM)的反复破坏、修复和重建。其中,特发性肺纤维化(IPF)发病率最高,间质性肺病中最常见的且预后极差的疾病,除肺移植外目前尚无治愈的方法。患者确诊IPF后中位生存期仅为2~3年,5年生存率低于30%,且有研究表明15% IPF患者最终发展为肺癌。
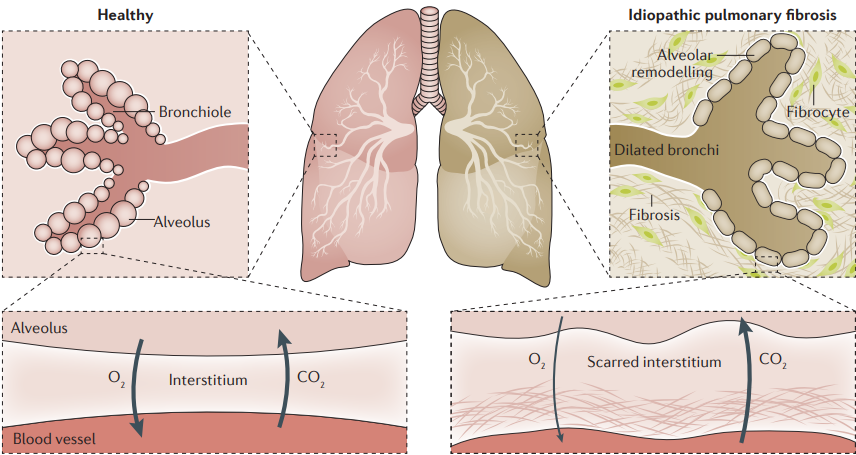
图4 特发性肺纤维化中的肺泡损伤(doi.10.1038/nrdp.2017.74)
理想的动物模型必须能复制典型肺纤维化病理表现,包括肺纤维化持续或不可逆进展,且经济成本低、模型可重复、成模时间短。目前用于PF模型制作的诱导剂众多,如博来霉素(bleomycin,BLM)、胺碘酮、高浓度氧、百草枯、二氧化硅、石棉等,其中以BLM诱导的PF模型由于病理组织学改变与人类PF临床表现最为接近而应用最普遍。BLM是由轮枝链霉菌产生的碱性糖肽类物质的多组份复合抗生素,是一种广谱抗肿瘤药物常用于恶性肿瘤治疗,其最大的毒副作用是导致肺纤维化。其诱导肺纤维化的机制普遍认为是BLM诱导DNA的断裂,产生自由基,诱导氧化应激反应,引起细胞凋亡或坏死,诱导炎症反应和纤维化。
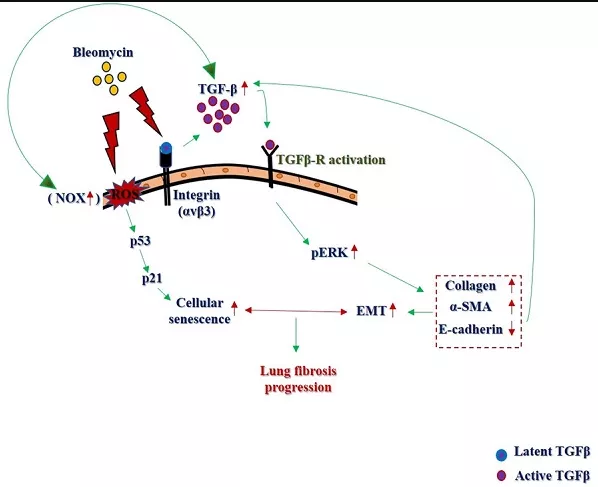
图5 BLM诱导肺纤维化机制
方法:6-8周龄雄性C57BL/6小鼠,麻醉后垂直固定于操作板上,气管内滴注 BLM(3~5 mg/kg),21~28天即可复制PF模型。
04慢性阻塞性肺病模型
慢性阻塞性肺疾病(chronic obstructive pulmonarydisease,COPD)简称慢阻肺,是一种气流受限不完全可逆、呈进行性发展的疾病,其特征是大量暴露于有害粒子或气体引起气道和/或肺泡异常造成的持续性呼吸道症状和气道受限。随着发达国家人口老龄化进展,发展中国家吸烟人数上升和生物燃料污染严重,世界卫生组织预计未来COPD的发病率将持续升高,到2060年可能将有超过540万人/年死于COPD及相关疾病。我国40岁以上人群COPD患病率约13.7%,近1亿患者,为我国第3位致死疾病,已成为我国重大公共卫生问题。
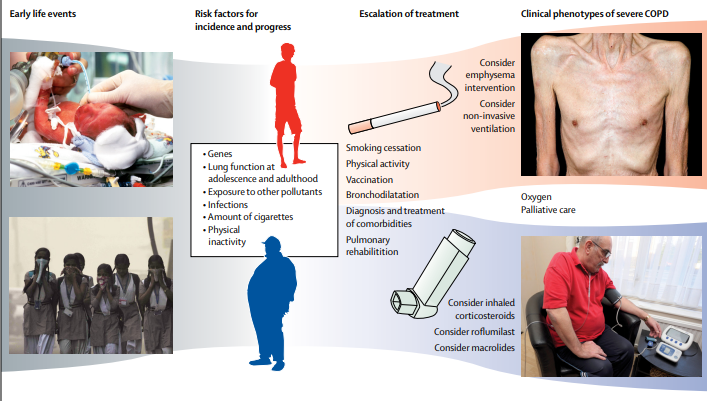
图6 COPD不同影响因素(DOI: https://doi.org/10.1016/S0140-6736(17)31222-9)
作为一种高致残率和高病死率的疾病,COPD的防治始终是临床和基础研究的重点之一。建立与临床患者疾病发生发展及病理变化相符合的动物模型,是研究COPD发病机制与治疗药物的基础。吸烟及二手烟暴露是COPD最基础的刺激因素,而呼吸道感染是COPD发病的最主要诱发因素,故目前最常用的COPD动物模型复制方法有两种,即烟草烟雾暴露(cigarette smoke exposure,CSE)以及CSE联合细菌脂多糖(lipopolysaccharide,LPS)暴露(CSE+LPS)。
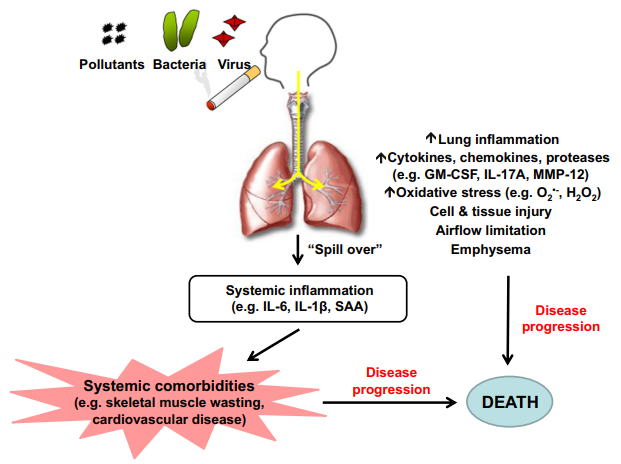
图7 香烟引起的肺部炎症和损伤(.doi.org/10.1016/j.ejphar.2015.03.029)
方法一:CSE暴露模型
CSE是引发COPD发生的首要因素,香烟烟雾可诱导中性粒细胞、淋巴细胞和巨噬细胞数量增加,释放促炎因子表达引起肺部炎症。将小鼠(6~8 周龄C57BL/6 小鼠)放入全身暴露感染箱中点燃香烟进行熏烟,每次熏烟 25 支,每次40 min,每日2次,连续熏烟8周。
方法二:CSE+LPS诱导模型
选用 6-8周龄雄性C57BL/6小鼠进行香烟烟熏,每天两次,每次10支,每周熏6天,于第1、14、28、42天向小鼠气管内注入LPS,给予LPS当天不熏烟,造模8周。
05 肺动脉高压模型
肺动脉高压(pulmonary hypertension, PH)是一种罕见的进行性疾病,其特征是肺血管阻力增加,静息平均肺动脉压≥25mmHg,导致右心室衰竭和过早死亡。PH的常见形式包括肺动脉高压(pulmonary arterial hypertension,PAH)、慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)、左心疾病引起的PH和肺部疾病引起的PH。PAH以前被认为是无法治愈的,自从1999年药物依前列醇问世以来,PAH的治疗取得了显著进展,三年生存率从30%~40%提高到85%以上。随着对PAH流行病学、发病机制和病理生理学的深入了解,在过去的几十年里,肺血管疾病领域的研究呈爆炸式增长,可用于特异性治疗PAH的药物包括内皮素受体拮抗剂、5型磷酸二酯酶抑制剂、可溶性鸟苷酸环化酶刺激剂、前列环素类似物和前列环素受体激动剂。
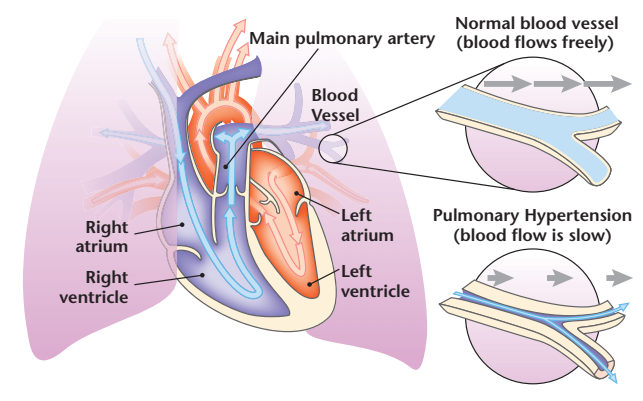
图8 肺动脉高压(doi: 10.1164/rccm.2035P12.)
在过去的三十年里,两种啮齿动物模型一直是研究PH的核心:慢性缺氧(chronic hypoxia,CHP)暴露模型和野百合碱(MCT)肺损伤模型。尽管能够在一定程度上了解缺氧诱导的血管重塑机制,但在这种啮齿动物模型中并没有出现在患有严重PAH的人类患者身上发现的复杂闭塞性病变。MCT大鼠模型目前仍然是PAH的常见研究模型,具有技术简单、可重复和低成本的特点。
方法一:CHP暴露模型
CHP会引起内皮细胞损伤,以致相关舒缩因子失衡,增加肺血管收缩反应并促进血管重塑,最终发展为PAH。CHP模型需将动物置于常压低氧高二氧化碳氧仓中,仓内氧浓度维持在9%~11%,二氧化碳浓度维持在5%~6%,每天8 h,每周6 d,连续4周。
方法二:MCT诱导模型
MCT是一种吡咯里西啶生物碱,存在于植物紫花野百合中。MCT必须在体内经肝脏细胞色素P4503A4代谢成毒性代谢物MCTP,进而导致血管内皮细胞损伤和炎症反应。不同物种和种系对MCT反应不同,目前研究野百合碱诱导的PH的首选物种是大鼠,即使给予小鼠MCTP也不能获得预期的结果。选用雄性SD大鼠,在后颈部或腹部皮下单次次注射MCT(60 mg/kg),21天可造模成功,模型能够模拟人类PAH的几个关键方面,包括血管重构、内皮功能障碍、SMC增殖、炎性细胞浸润和右心室衰竭。
二、派思维新呼吸系统疾病模型案例研究
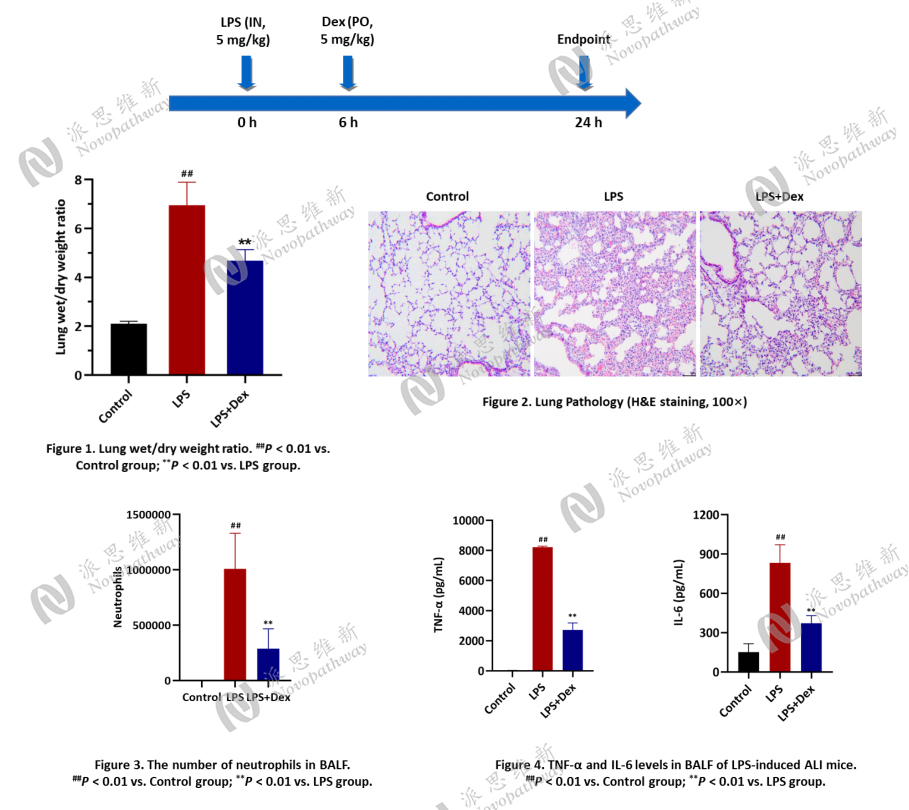
Case Study 1 : LPS-Induced Acute Lung Injury in BALB/c mice
Aim: To examine the effect of dexamethasone on LPS-induced acute lung Injury in BALB/c mice.
Animal: BALB/c, female, 6-8 weeks, 18-20 g.
Reagent: LPS, Dexamethasone (Dex).
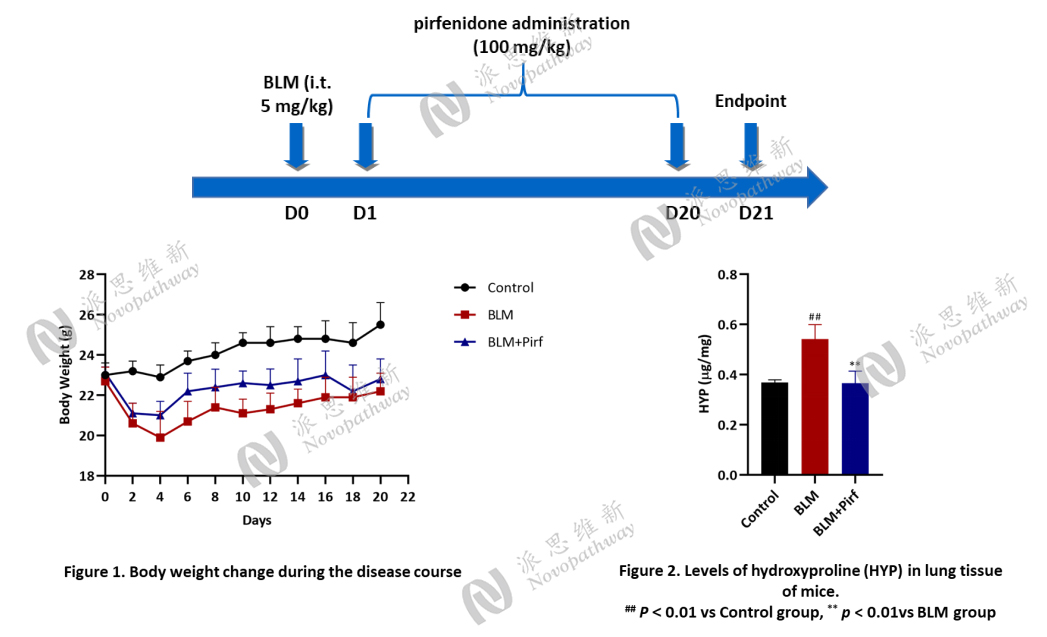
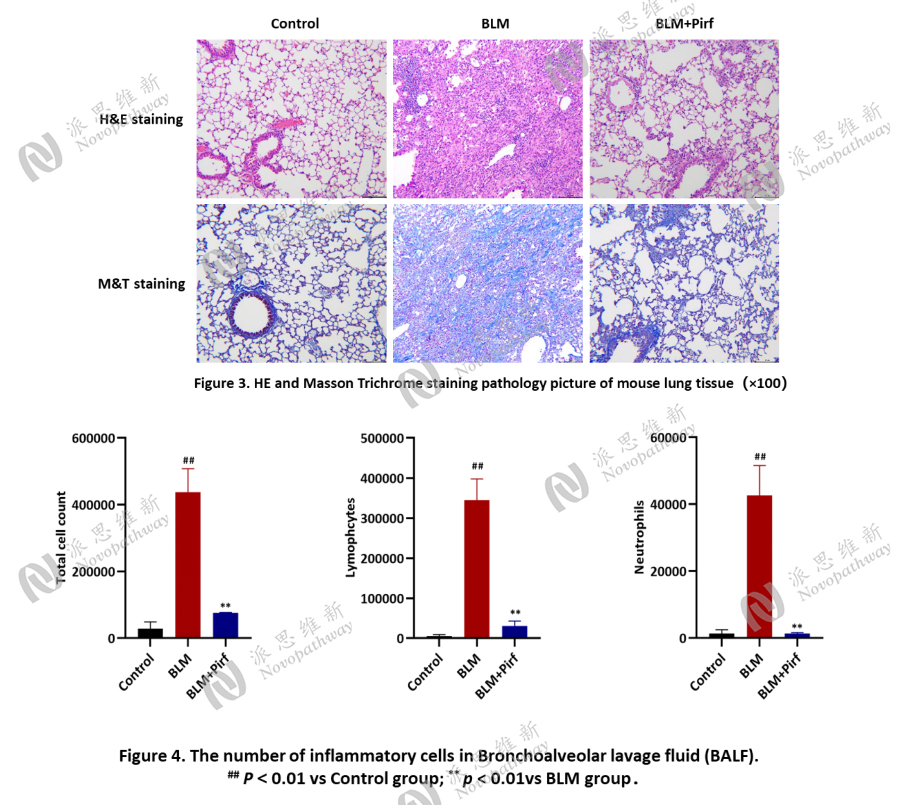
Case Study 2 : BLM-Induced pulmonary fibrosis in C57BL/6 mice
Aim: To examine the effect of dexamethasone on BLM-induced pulmonary fibrosis in C57BL/6 mice.
Animal: C57BL/6, female, 6-8 weeks, 18-20 g.
Reagent: BLM, Pirfenidone (Pirf).
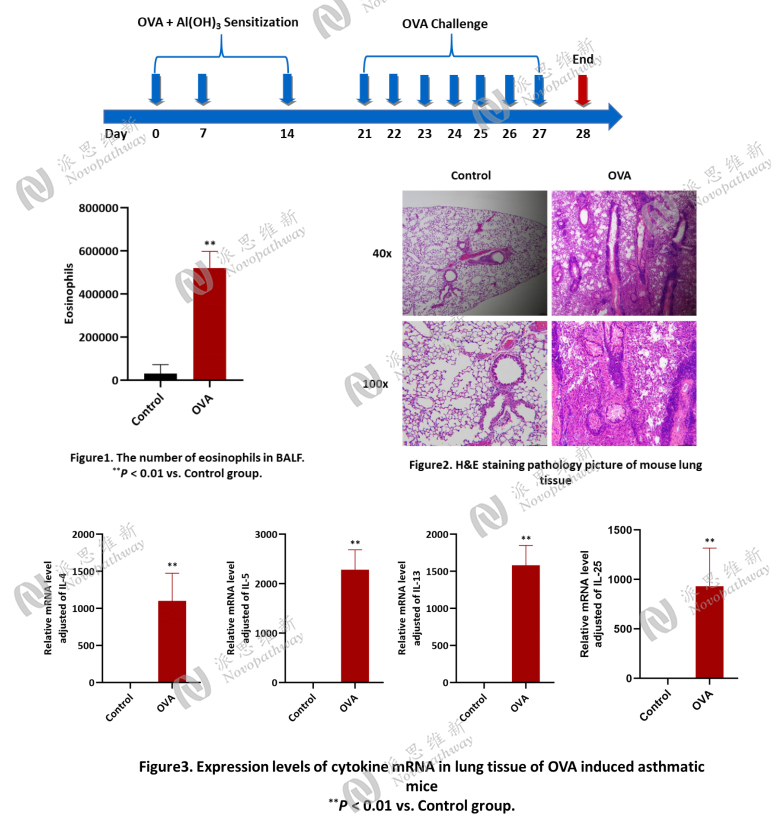
Case Study 3 : OVA-Induced bronchial asthma in BALB/c mice
Aim: To establish an ovalbumin (OVA)-induced bronchial asthma model in BALB/c mice.
Animal: BALB/c mice, female, 6-8 weeks, 18~22g.
Reagent: Ovalbumin, Dried Aluminum Hydroxide Gel.
参考文献:
[1] Croisant S. Epidemiology of asthma: prevalence and burden of disease. Adv Exp Med Biol 2014; 795: 17-29.
[2] Global Initiative for Asthma Global Strategy for Asthma Management and Prevention Updated 2017. 2/11/2017. Report No.
[3] Han RT, Kim S, Choi K, et al. Asthma-like airway inflammation and responses in a rat model of atopic dermatitis induced by neonatal capsaicin treatment [J]. J Asthma Allergy, 2017, 10: 181-189.
[4] Pedro GB, Aun MV, Takejima P, et al. United airway disease: current perspectives [J]. J Asthma Allergy, 2016, 9: 93-100.
[5] Kroegel C, Wirtz H. History of guidelines for the diagnosis and management of asthma: from opinion to control [J]. Drugs, 2009, 69(9): 1189-1204.
[6] Reddy Aravind T,Lakshmi Sowmya P,Reddy Raju C,Murine model of allergen induced asthma.[J] .J Vis Exp, 2012, undefined: e3771.
[7] Fanelli V, Ranieri VM. Mechanisms and clinical consequences of acute lung injury[J]. Ann Am Thorac Soc, 2015, 12(Suppl 1): S3-S8.
[8] Butt Y, Kurdowska A, Allen TC. Acute lung injury: a clinical and molecular review[J]. Arch Pathol Lab Med, 2016, 140(4): 345-350.
[9] Hughes KT, Beasley MB. Pulmonary manifestations of acute lung injury: more than just diffuse alveolar damage[J]. Arch Pathol Lab Med, 2017, 141(7): 916-922.
[10] World Health Organization.Projection of mortality and cause of death,2016 to 2060[EB/OL].[2019-10-14].http://www.who. int/healthinfo/global_burden_disease/projections/en/.
[11] WANG C,XU J Y,YANG L,et al.Prevalence and risk factors of chronic obstructive pulmonary disease in China(the China Pulmonary Health[CPH]study):a national cross-sectional study[J].Lancet,2018,391(10131):1706-1717.DOI:10.1016/S0140- 6736(18)30841-9.
[12] GUAZZI M, NAEIJE R. Pulmonary Hypertension in Heart Failure: Pathophysiology, Pathobiology, and Emerging Clinical Perspectives[J]. Journal of the American College of Cardiology, 2017, 69(13): 1718-1734.
[13] Kondo T, Okumura N, Adachi S, Murohara T. <Editors' Choice> Pulmonary Hypertension: Diagnosis, Management, and Treatment. Nagoya J Med Sci. 2019 Feb;81(1):19-30. doi: 10.18999/nagjms.81.1.19. PMID: 30962652; PMCID: PMC6433622.
[14] Gomez-Arroyo JG, Farkas L, Alhussaini AA, Farkas D, Kraskauskas D, Voelkel NF, Bogaard HJ. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 2012 Feb 15;302(4):L363-9. doi: 10.1152/ajplung.00212.2011. Epub 2011 Sep 30. PMID: 21964406.
[15] Bueno-Beti C, Hadri L, Hajjar RJ, Sassi Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods Mol Biol. 2018;1816:243-252. doi: 10.1007/978-1-4939-8597-5_19. PMID: 29987825.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




