- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

派思维新 | 医疗器械动物试验的决策-DMPK
01 前言
医疗器械的安全性、有效性以及生物相容性研究应采用科学、合理的评价方法,其中动物试验是重要手段之一。动物实验可以模拟人体内部环境和生理机制,帮助科研人员更全面地评估医疗器械对生物体的影响,从而减少潜在的风险和危害。此外,动物实验也可以为后续的临床试验提供必要的数据支持,为医疗器械的上市申请提供有力的科学依据,但并不是所有医疗器械均需要通过动物试验验证产品安全性和有效性。
为了对开展动物试验的必要性判定提供指导,减少动物试验研究数量,避免开展不必要的动物试验,国家药监局发布了《医疗器械动物试验研究注册审查指导原则第一部分:决策原则(2021年修订版)》。可参考以下决策流程图进行是否开展动物试验的决策。
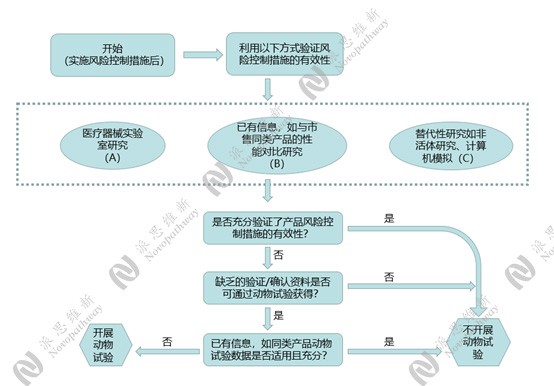
02 哪些情况无需开展动物实验?
①已有信息,与市售同类产品的性能对比研究或同类产品动物试验数据适用且充分。
②医疗器械实验室研究,如心电图机,可进行实验室研究,通过心电图标准数据库来验证心电图自动测量的准确性,可通过形态诊断用心电图数据库和节律诊断用心电图数据库来确认公开形态解释的准确性和公开节律诊断的准确性,无需开展动物试验[1]。
③替代性研究,患者在植入心脏起搏器后一般不能进行核磁共振检查(MRI),如果申请人设计开发了MRI兼容的植入式心脏起搏器,需要评估MRI环境对产品安全性及有效性带来的影响,进行MRI兼容性相关研究。MRI兼容性研究通常需要应用动物进行计算机建模验证MRI兼容的安全性与有效性,当验证过计算机建模的准确性后,对于同一申请人其他植入式心脏起搏器产品的MRI兼容性研究,可以不再重复进行动物试验[1]。
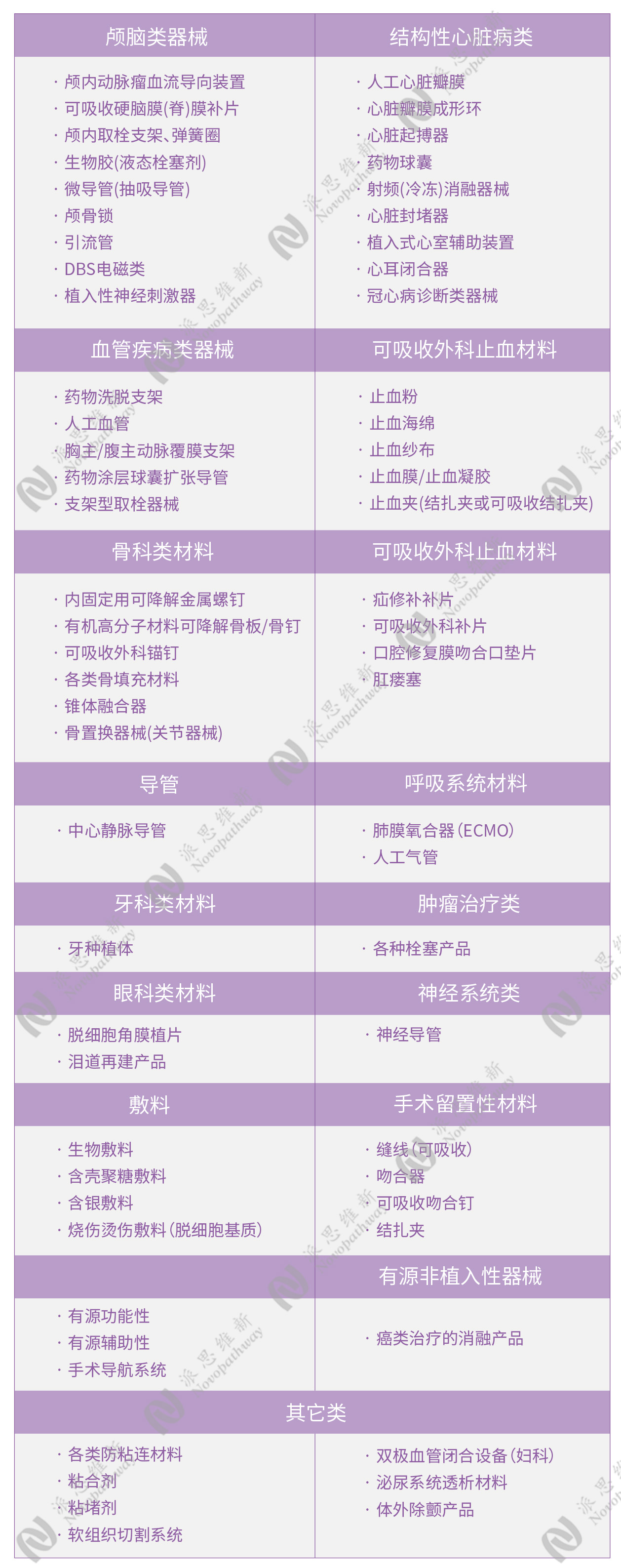
03 怎么选择动物?
小动物在医疗器械试验中主要用于生物相容性研究、早期可行性评估和短期效果测试。它们的优势在于繁殖快、成本低、易于管理,能够快速提供初步数据,为后续的大动物实验和临床试验提供科学依据。
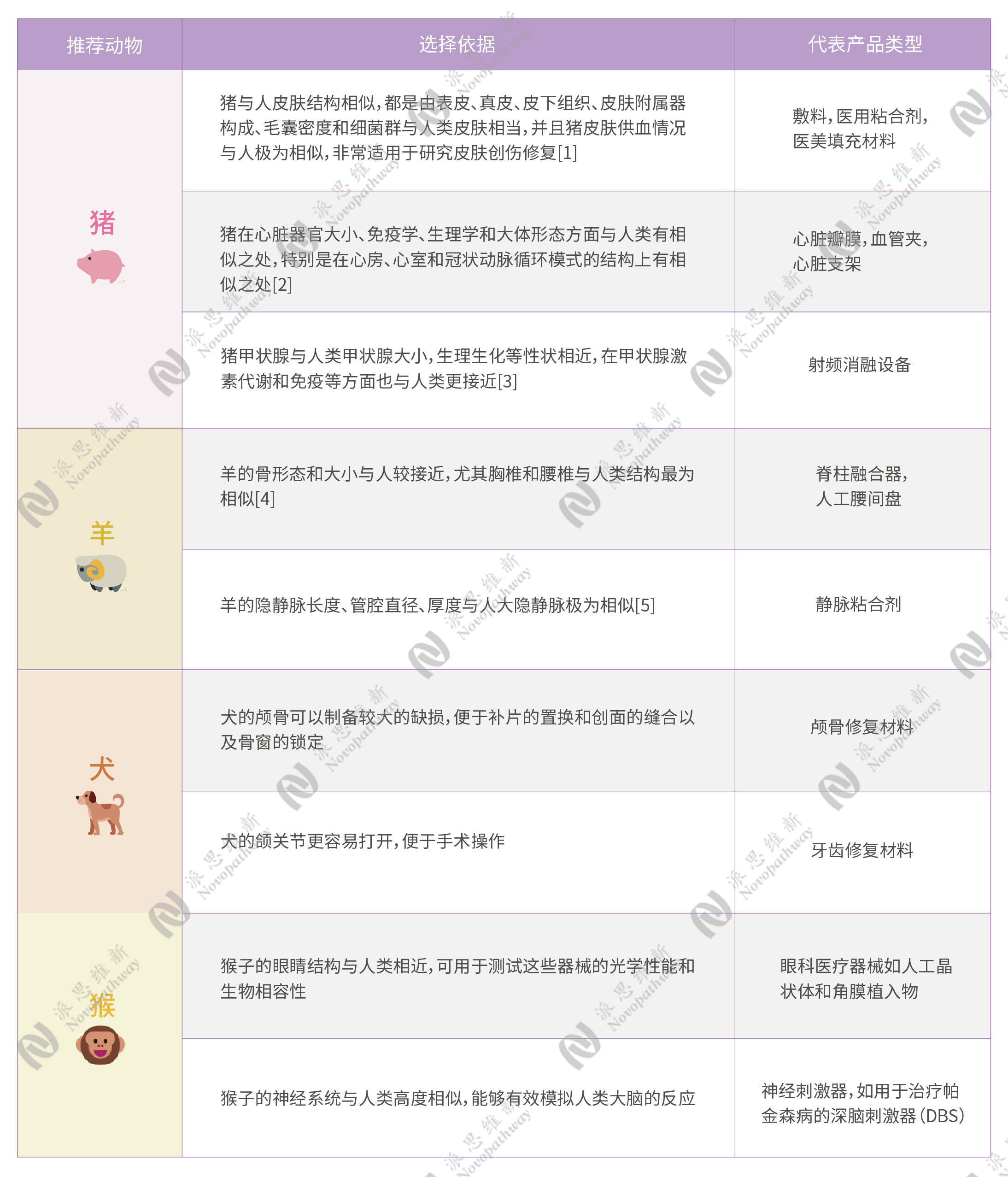
04 未来展望
随着技术的进步,计算机模拟和体外模型等替代方法逐渐应用于医疗器械的研发中。然而,动物试验在当前医疗器械研发中仍具有不可替代的作用,尤其是在验证复杂医疗器械的安全性和有效性时。未来,如何在减少动物使用的同时提高试验的科学性和效率,将是行业关注的重点。
05 小结
医疗器械种类繁多,但并不是所有产品均需开展动物试验,在产品设计开发阶段应参考“决策开展动物试验的流程图”,结合动物福利伦理原则、风险管理原则,决策是否需开展动物试验。通过前期研究,如实验室研究,对风险控制措施的有效性进行验证。仅在实验室研究数据信息不足的情况下,才考虑通过动物试验开展进一步确认。建议优先选择非活体研究、计算机模拟等方法替代动物试验,充分利用已有的同类产品动物试验数据或通过与市售同类产品进行性能对比等方式获取证据,以减少动物试验。若明确需做动物实验,在动物种类的选择上,应结合临床使用情况和场景来选择最接近或最适宜的动物进行相应评价。
[5] Wilke HJ, Kettler A, Wenger KH, Claes LE. Anatomy of the sheep spine and its comparison to thehuman spine. AnatRec.1997;247:542-555.
[6] Barnat N, Grisey A, Gerold B, et al. Efficacy and safety assessment of an ultrasound-based thermal treatment of varicose veins in a sheep mode[J]. Intemational Journal of Hyperthermia, 2020,37(1):231-244.

上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




