- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

派思维新 | 实验动物模型带您探索骨和关节疾病新药研发新希望
01 前言
骨与关节疾病是全球范围内影响人类健康的主要问题之一,尤其是中老年人群和特定职业群体。常见疾病包括:骨关节炎(退行性疾病)、骨质疏松症、类风湿关节炎等。骨与关节疾病多呈慢性进展,早期症状易被忽视,但致残风险高。例如,骨关节炎若未及时干预,可能需人工关节置换;类风湿关节炎延误治疗将导致不可逆关节损伤。
02 类风湿性关节炎和动物模型
类风湿性关节炎简介:
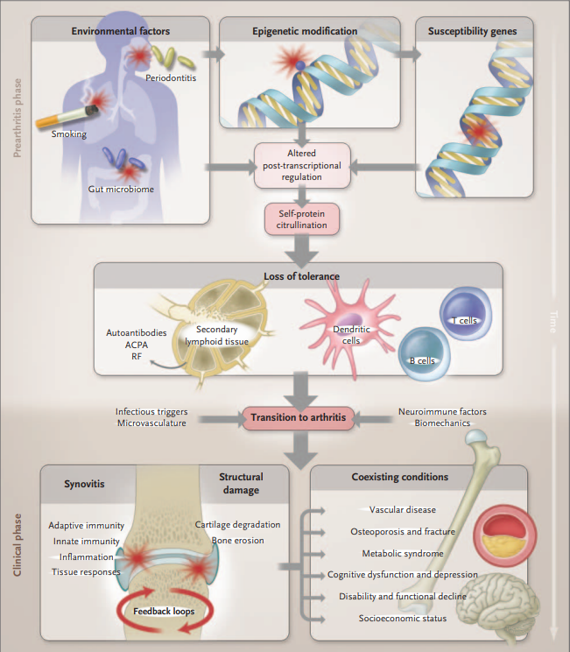
Figure 1. Multistep Progression to the Development of Rheumatoid Arthritis (DOI:10.1056/NEJMra1004965).
临床症状和并发症:
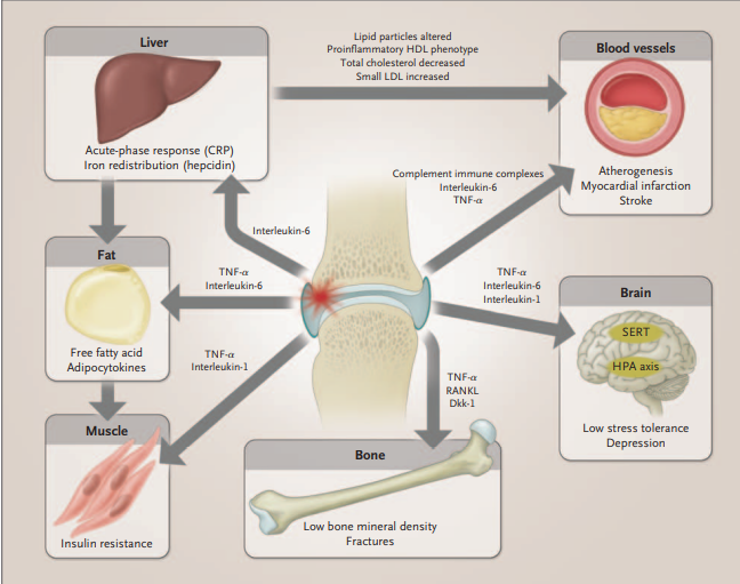
Figure 2. Mechanisms That Contribute to Clinically Observed Long-Term Complications in Patients with Rheumatoid Arthritis (DOI: 10.1056/NEJMra1004965).
类风湿性关节炎动物模型:
动物模型的建立和应用是研究疾病的有效方法,有效的动物模型有助于了解疾病的发病机制,也能够筛选出有效的治疗药物。目前多种动物模型已被广泛用于RA的病因、发病机制、新治疗靶点等的研究和新疗法的评估,包括诱导性、转基因型、自发性及病证结合动物模型,其中,佐剂诱导的大鼠关节炎模型、胶原诱导的大、小鼠关节炎模型和胶原抗体诱导的小鼠关节炎模型是目前研究RA最为广泛和经典的模型。
佐剂诱导的大鼠关节炎模型(Adjuvant-induced arthritis in mice,AA)
基于抗原模拟机制,位于结核杆菌的一个蛋白分子MtbH37Ra与关节滑膜上的一个糖蛋白分子HSP650结构相似,可以被同一株T细胞克隆所识别,从而诱发针对关节的免疫反应。
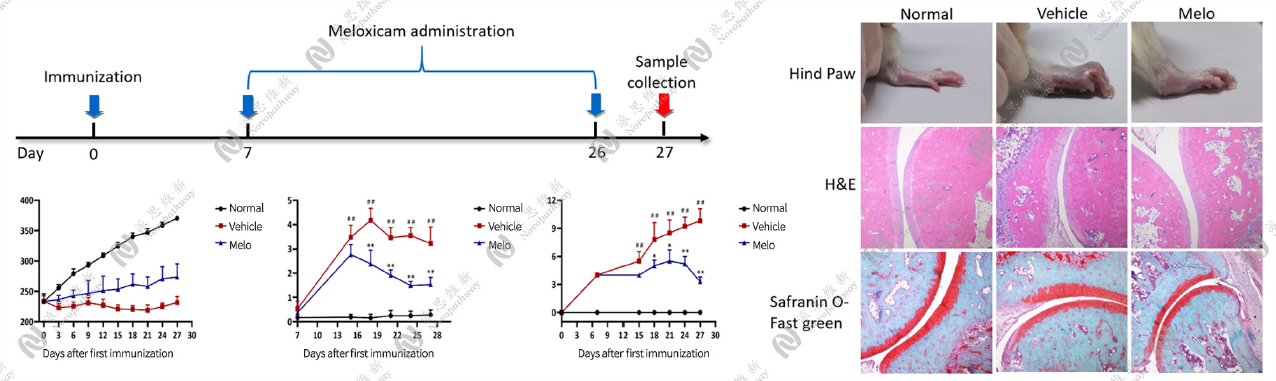
胶原诱导的关节炎模型(Collagen-induced arthritis,CIA)
胶原蛋白是细胞外间质成分,分为Ⅰ、Ⅱ、Ⅲ型。Ⅰ型和Ⅲ型胶原存在于皮肤和一些器官的间质中,而Ⅱ型胶原大量存在于关节软骨中。用异源性Ⅱ型胶原免疫动物,可诱导体内产生针对关节软骨中的Ⅱ型胶原的自身免疫反应,建立关节炎模型。
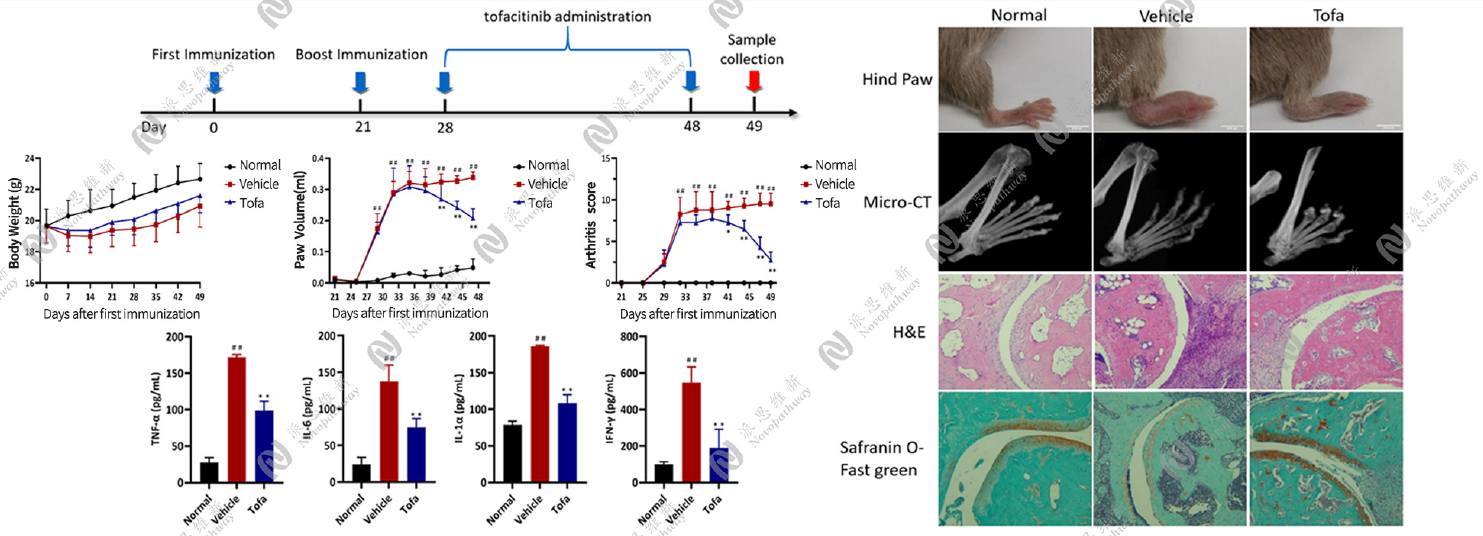
胶原诱导小鼠关节炎模型
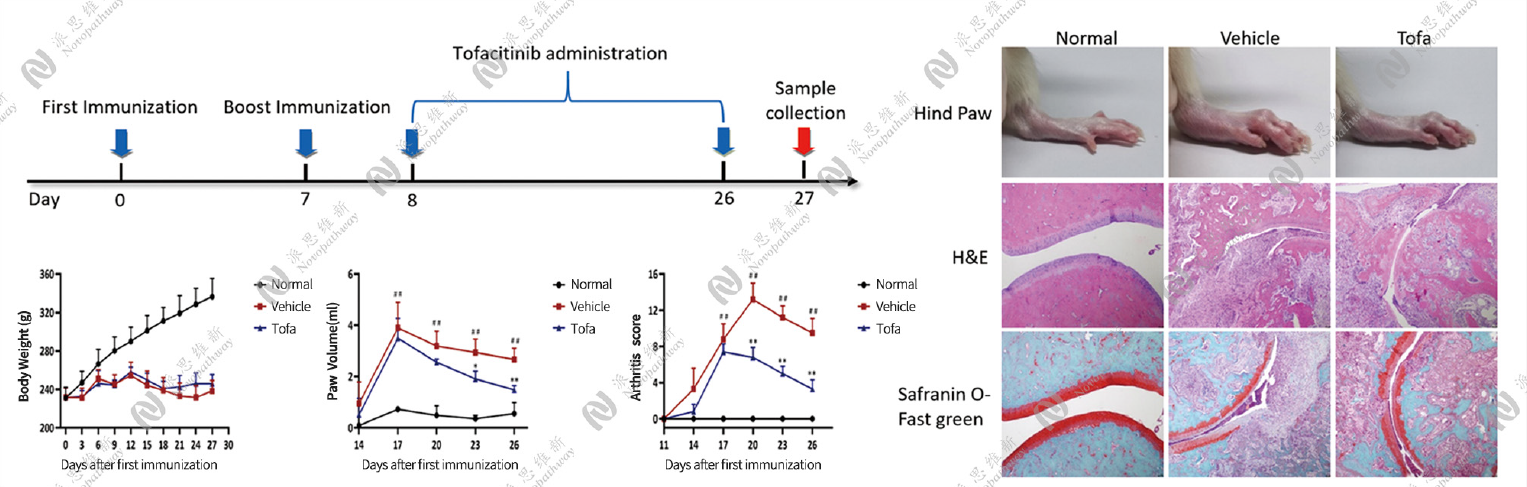
胶原诱导大鼠关节炎模型
03 骨关节炎和动物模型
骨关节炎简介:
分类及病因:
临床表现:
OA动物模型:
自发型:
诱发性动物模型:
前交叉韧带切除术诱导的OA模型
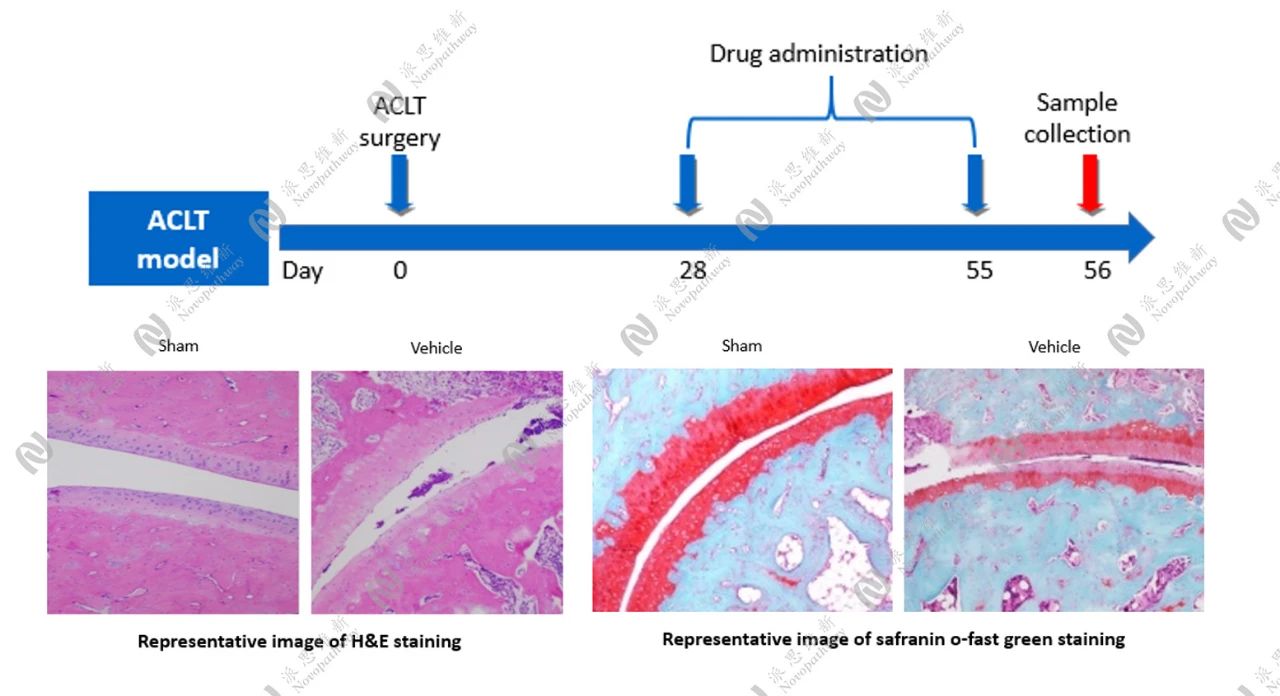
04 骨质疏松和动物模型
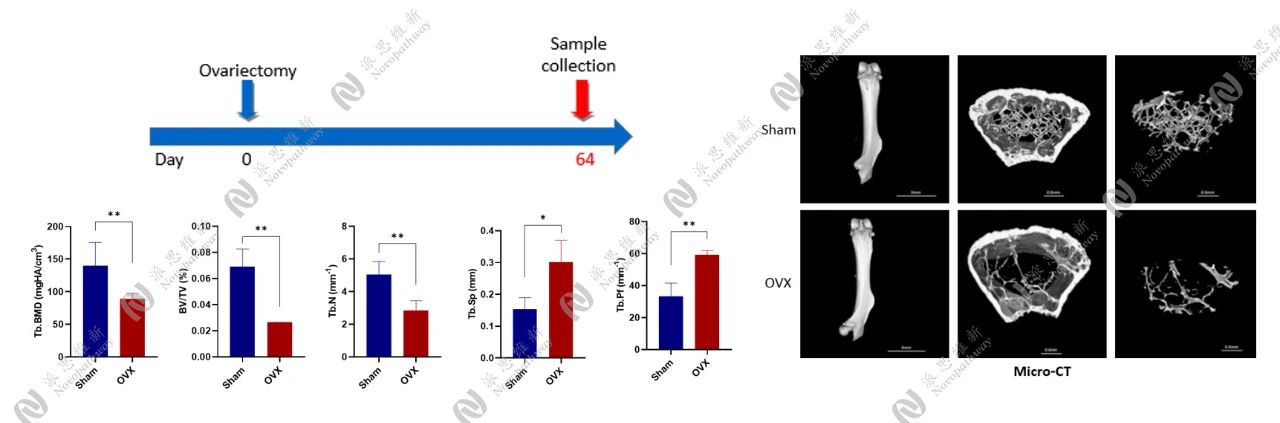
骨质疏松简介:
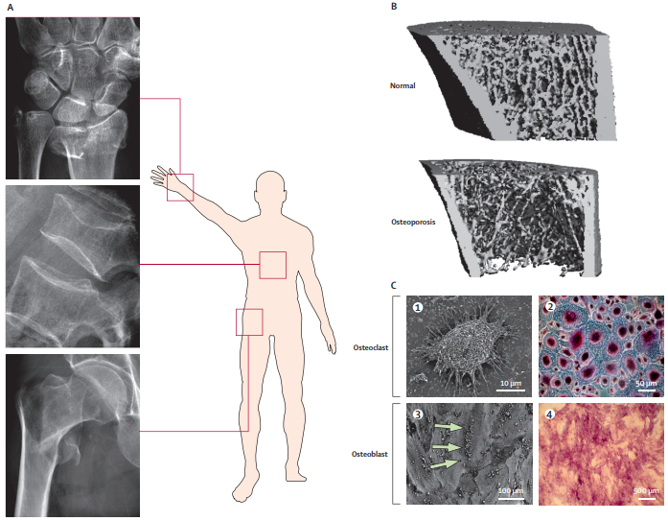
骨质疏松模型:
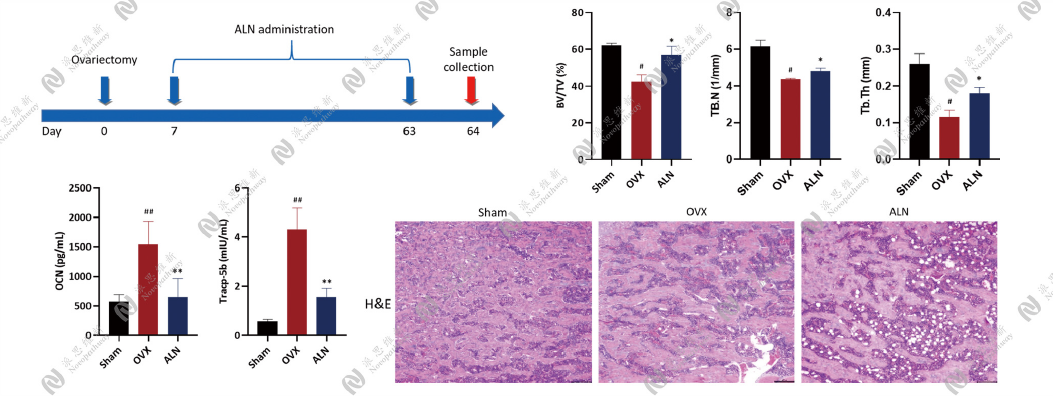
OVX诱导小鼠骨质疏松模型
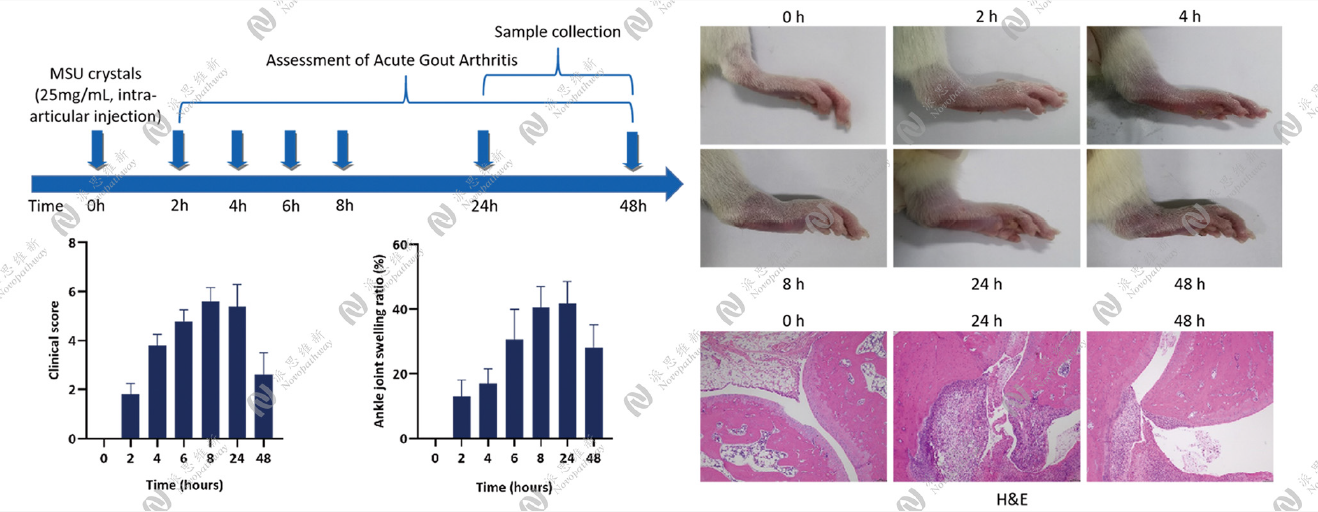
05 痛风性关节炎和动物模型
简介
痛风性关节炎(goutyarthritis)是一种由尿酸代谢异常引发的炎症性关节病,血液中尿酸水平过高(高尿酸血症),导致尿酸盐结晶沉积在关节及周围组织,引发急性炎症反应。受遗传因素影响,多累及大脚趾(第一跖趾关节),也可波及踝、膝、腕等关节。关节组织周围出现红肿发热,伴随压痛。急性发作时,突发剧烈疼痛,常见于夜间或清晨。
自1990年以来,全球痛风患病率增长了22.5%(20.9–24.2%)。男性的痛风患病率是女性的3.26倍(3.11–3.39),而且患病率随年龄增长而增加。预计到2050年,全球痛风患者将增至9580万(8110万至1.16亿)。
MSU诱导痛风关节炎模型:
由于关节部位析出的尿酸钠晶体是造成痛风性关节炎的关键,所以现常用尿酸钠(MSU)诱导构建动物模型。
参考文献
[1] Kim E Y, Durai M, Mia Y, et al. Modulation of adjuvant arthritis by cellular and humoral immunity to Hsp65[J]. Front Immunol, 2016, 7: 203.
[2] McInnes, Iain B, Schett, Georg. The Pathogenesis of Rheumatoid Arthritis [J]. New Engl J Med, 2011, 365 (23), 2205–2219.
[3] InglisJuliaJ, CriadoGabriel, MedghalchiMinoetal. Collagen-induced arthritis in C57BL/6 mice is associated with arobustand sustained T-cell response to typeIIcollagen [J]. Arthritis Res Ther, 2007, 9 (5): R113.
[4] Griffiths MM. Immunogenetics of collagen induced arthritis in rats [J]. Int Rev Immunol, 1988, 4 (1): 1-15.
[5] Bäcklund J, Li C, Jansson E, et al. C57BL/6 mice need MHC classⅡAq to develop collagen-induced arthritis dependent on autoreactive T cells[J]. Ann Rheum Dis, 2013, 72 (7): 1225-1232.
[6] Khachigian L M. Collagen antibody-induced arthritis[J]. Nat Protoc, 2006, 1(5) : 2512-6.
[7] Terato K, Hasty K A, Reife R A, et al. Induction of arthritis with monoclonal antibodies to collagen[J]. J Immunol, 1992, 148 (7) : 2103-8.
[8]唐玉玲,王进,邱业峰,袁征.骨关节炎动物模型的概述[J].实验动物科学,2020,v.37(06):70-75.[9]卢向阳,唐芳,马武开,姚血明,陈琳英,周静.骨关节炎动物模型的研究进展[J].风湿病与关节炎,2017,v.6(02):63-67+75.
[10]韩明睿,刘倩倩,孙洋.骨关节炎发病机制及药物调控新进展[J].中国药理学通报,2022,v.38(06):807-812.
[11]刘晓辰,付维力.骨关节炎动物模型的选择[J].中国组织工程研究,2020,24(11):1769-1776.
[12]刘康妍,郑聪,胡海澜.骨关节炎流行病学研究[J].中华关节外科杂志(电子版),2017,v.11(03):320-323.
[13] Rachner TD, Khosla S, Hofbauer LC. Osteoporosis: now and the future. Lancet. 2011 Apr 9;377(9773):1276-87. doi: 10.1016/S0140-6736(10)62349-5. Epub 2011 Mar 28. PMID: 21450337; PMCID: PMC3555696.
[14] Tao Z, Wang J, Wen K, Yao R, Da W, Zhou S, Meng Y, Qiu S, Yang K, Zhu Y, Tao L. Pyroptosis in Osteoblasts: A Novel Hypothesis Underlying the Pathogenesis of Osteoporosis. Front Endocrinol (Lausanne). 2021 Jan 8;11:548812. doi: 10.3389/fendo.2020.548812. PMID: 33488513; PMCID: PMC7821870.
[15] Huidrom S, Beg MA, Masood T. Post-menopausal Osteoporosis and Probiotics. Curr Drug Targets. 2021;22(7):816-822. doi: 10.2174/1389450121666201027124947. PMID: 33109043.
[16] Zhang Y, Li M, Liu Z, Fu Q. Arbutin ameliorates glucocorticoid-induced osteoporosis through activating autophagy in osteoblasts. Exp Biol Med (Maywood). 2021 Jul;246(14):1650-1659. doi: 10.1177/15353702211002136. Epub 2021 Mar 23. PMID: 33757338; PMCID: PMC8326434.
[17] Krishnan V, Bryant HU, Macdougald OA. Regulation of bone mass by Wnt signaling. J Clin Invest. 2006 May;116(5):1202-9. doi: 10.1172/JCI28551. PMID: 16670761; PMCID: PMC1451219.
[18] Zhang Z, Ren H, Shen G, Qiu T, Liang D, Yang Z, Yao Z, Tang J, Jiang X, Wei Q. Animal models for glucocorticoid-induced postmenopausal osteoporosis: An updated review. Biomed Pharmacother. 2016 Dec;84:438-446. doi: 10.1016/j.biopha.2016.09.045. Epub 2016 Sep 28. PMID: 27685786.
[19] Lin S, Huang J, Zheng L, Liu Y, Liu G, Li N, Wang K, Zou L, Wu T, Qin L, Cui L, Li G. Glucocorticoid-induced osteoporosis in growing rats. Calcif Tissue Int. 2014 Oct;95(4):362-73. doi: 10.1007/s00223-014-9899-7. Epub 2014 Aug 3. PMID: 25086673.
[20] Chen L, Shi X, Xie J, Weng SJ, Xie ZJ, Tang JH, Yan DY, Wang BZ, Fang KH, Hong CX, Wu ZY, Yang L. Apelin-13 induces mitophagy in bone marrow mesenchymal stem cells to suppress intracellular oxidative stress and ameliorate osteoporosis by activation of AMPK signaling pathway. Free Radic Biol Med. 2021 Feb 1;163:356-368. doi: 10.1016/j.freeradbiomed.2020.12.235. Epub 2020 Dec 30. PMID: 33385540.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




