- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

小分子耐药动物模型临床前研发的重要性
01 癌症现状
癌症是一种异质性且高度复杂的疾病,每年夺走数百万人的生命,是全球主要死因之一。癌症导致的死亡人数不断增加,变得越来越普遍和严重,据估计到 2030 年,预计每年约有 3000 万人死于癌症。这就是为什么癌症对全球公共卫生来说是一个非常严峻的挑战。目前有四种常规的癌症治疗方法,包括手术、放射治疗、免疫治疗和化疗。
癌症化疗面临着许多挑战,例如癌细胞的非特异性靶向、治疗耐药以及即使在成功治疗后癌症复发,使用靶向小分子药物是改善化疗结果的方法之一。由于它们的分子量低(<1000 Da)和体积小,它们可以与细胞内外的各种靶标结合。自2001年美国食品药品监督管理局(FDA)批准首个小分子酪氨酸激酶抑制剂(TKI)药物伊马替尼获批临床以来,已有80多种用于癌症治疗的小分子药物获得美国FDA和中国国家药品监督管理局(NMPA)的批准。然而,靶向小分子的治疗效果有限。癌细胞使用多种因素和策略来对抗和抵抗化疗。
面对癌症形势,肿瘤耐药问题显得越发重要。
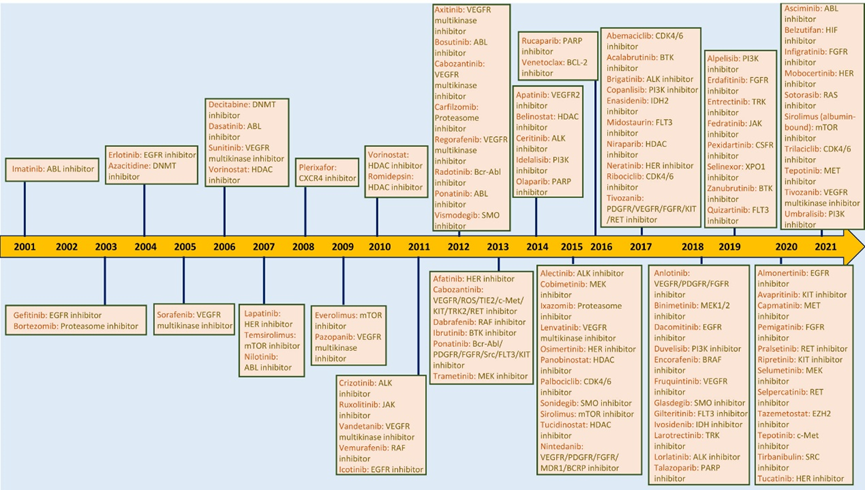
肿瘤耐药现象是肿瘤细胞对抗肿瘤治疗药物发展出的抵抗能力,导致治疗效果下降或完全失效,这一现象是当前肿瘤治疗领域面临的重大挑战之一。它极大地限制了化疗、靶向治疗和免疫治疗等治疗手段的效果。
肿瘤耐药的类型包括治疗性耐药、多药耐药(MDR)、靶点耐药、DNA损伤修复耐药、细胞凋亡逃逸耐药以及免疫耐药等。
02 药物耐药性
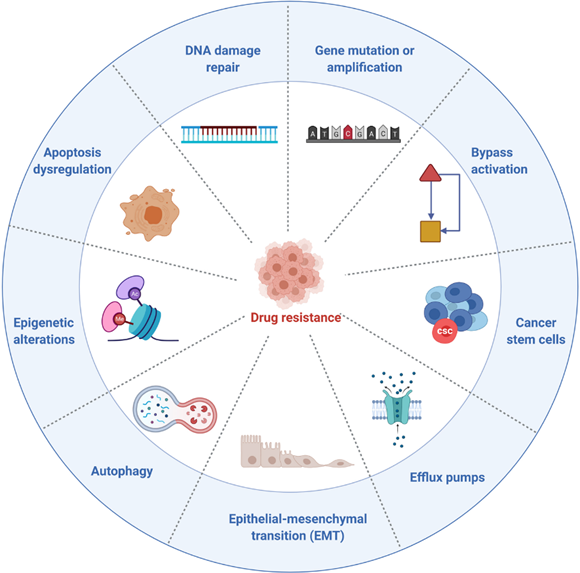
靶向抗癌药物的主要挑战是耐药性,几乎所有的靶向抗癌药物在临床使用一段时间后都会遇到耐药性。耐药性与许多机制有关,包括基因突变、扩增、CSC、外排转运蛋白、细胞凋亡失调和自噬等。
基因突变是导致抗癌耐药的主要原因:一是基因突变是由药物诱导的,二是耐药突变已经存在。在治疗的早期阶段,具有药物敏感突变的癌细胞占主导地位并抑制含有耐药突变的细胞的增殖。具有敏感突变的细胞被杀死后,耐药突变细成为主流并表现出耐药性。其他基因的扩增是抗癌耐药的另一个常见原因。例如,MET扩增约占EGFR抑制剂耐药病例的20%。除此之外,细胞死亡失调和自噬也可能是抗癌耐药的原因。[1]
FDA 于 2007 年根据 SHARP 试验的令人鼓舞的结果批准索拉非尼用于治疗晚期肝细胞癌(HCC),并于 2013 年根据 DECISION 试验的有益结果批准用于分化型甲状腺癌(DTC)。索拉非尼也是首个获批用于这三种癌症适应症的小分子靶向药物[2]。
以肝癌为例,肝癌在不同恶性肿瘤中的死亡率排名第三,发病率排名第七。在临床前实验中,索拉非尼在肝癌细胞系中具有抗增殖活性,在人肝细胞癌小鼠异种移植模型中减少了肿瘤血管生成和肿瘤细胞信号传导,增加了肿瘤细胞凋亡。然而索拉非尼耐药的发生越来越普遍,索拉非尼的临床缓解率低于 20%,总生存期获益受到原发性或继发性耐药性的限制。这可能是因为索拉非尼介导的抗血管生成作用导致血管过度修剪并增加缺氧,导致免疫抑制性肿瘤微环境(TME)的产生,其特征是调节性 T 细胞(Treg)和 M2 巨噬细胞的瘤内积累以及程序性死亡配体 1 (PD-L1)表达的上调,最终导致逃避耐药性[3]。
非小细胞肺癌(non-small cell lung cancer, NSCLC)分子检测已经发现了一个多样化的并且仍在扩大的驱动和维持肿瘤发生的异常遗传基因目录。其中,表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变是肺癌致瘤驱动因素的典型例子,可以作为治疗的靶点。大量的随机试验和meta分析证实了小分子EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)对EGFR突变型NSCLC患者的治疗优于细胞毒性药物,在客观缓解率(objective response rate, ORR)和无生存进展期(progression-free survival, PFS)方面具有显著的优势[5]。
03 派思维新非耐药和耐药模型案例对比
常用的体外耐药细胞株构建方法包括大剂量药物冲击法、药物浓度递增法以及两者的结合使用。经过多轮药物冲击后获得的耐药细胞模型,将与原始的野生型细胞进行对比,以其体外药敏检测的IC50值的比值,即RF值,为判断标准,来衡量耐药性的强弱,并以此作为耐药模型构建成功与否的评价标准。体内同样适用。
通过体内长期给药诱导的方式,成功构建了sorafenib耐药的Hepa1-6肝癌模型。
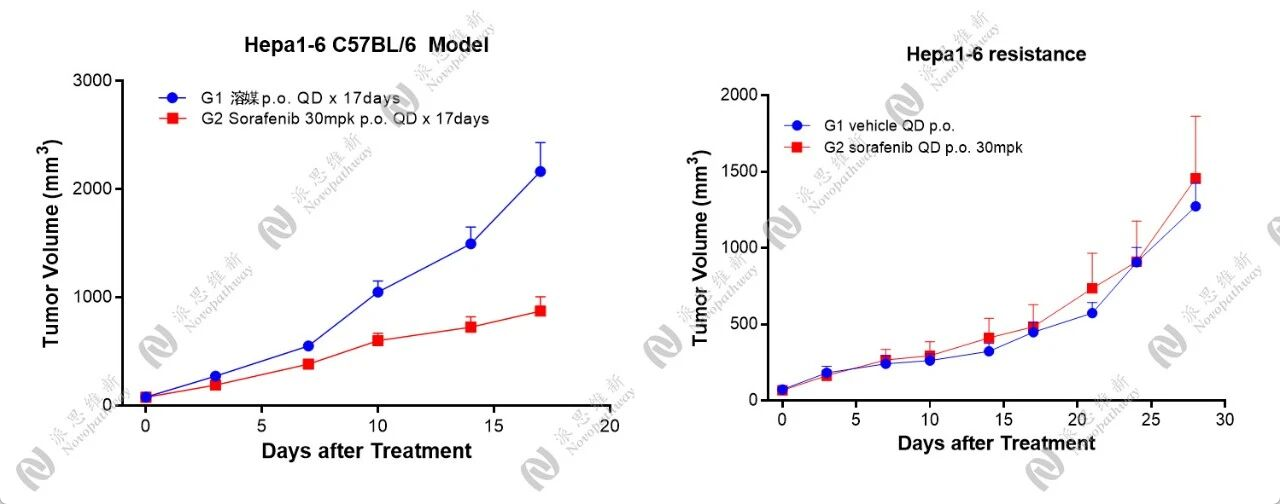
Sorafenib耐药的Hepa1-6肝癌模型
从肿瘤生长曲线可对比观察到,正常情况下30mpk的给药剂量有显著性药效,sorafenib耐药株则达到耐药效果。
奥希替尼继发性耐药机制是指初始对奥希替尼敏感,但在长期服用后,肺癌细胞基因改变,比如 EGFR突变或EGFR过表达,甚至不依赖于EGFR的其他基因突变等,激活一系列与细胞生长、凋亡相关的信号通路,导致癌细胞的生长不受控制,从而对奥希替尼产生抗性。
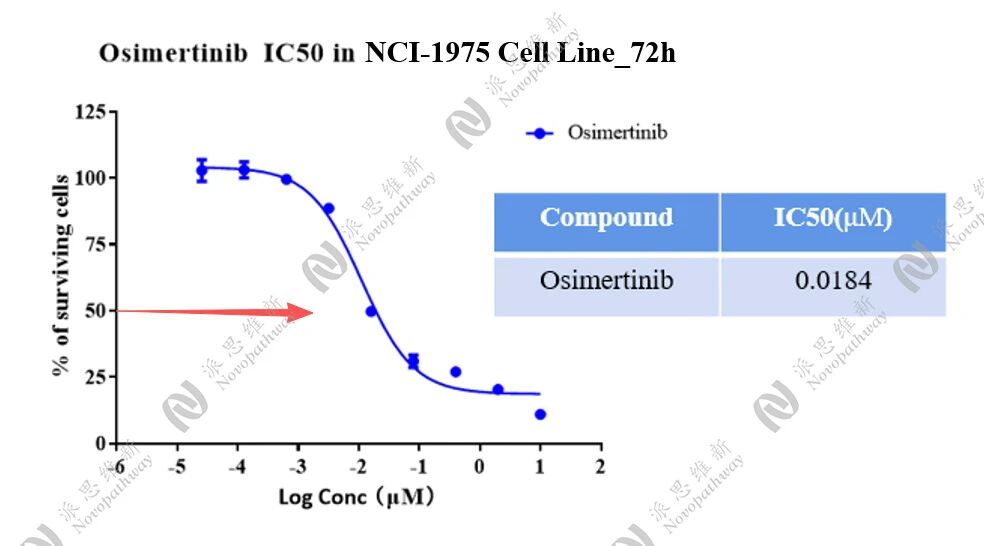
Osimertinb 在 NCI-1975 Cell非耐药模型上的效果
继发性耐药可分为EGFR依赖性耐药和 EGFR 非依赖性耐药。EGFR 依赖性耐药机制主要包括 EGFR 突变(G719X、 E709X、DEL19、EGFR ins20、C797X、L858R 突变等)。EGFR非依赖性耐药机制则包括MET扩增、HER2/3扩增、AXL激活和基因(ROS1、RET、 NTRK、ALX 等)融合,这些突变都通过下游 PI3K/ AKT/mTOR、Wnt、β-catenin、RAS/ERK/MAPK信号通路影响肺癌细胞增殖、迁移和奥希替尼耐药。
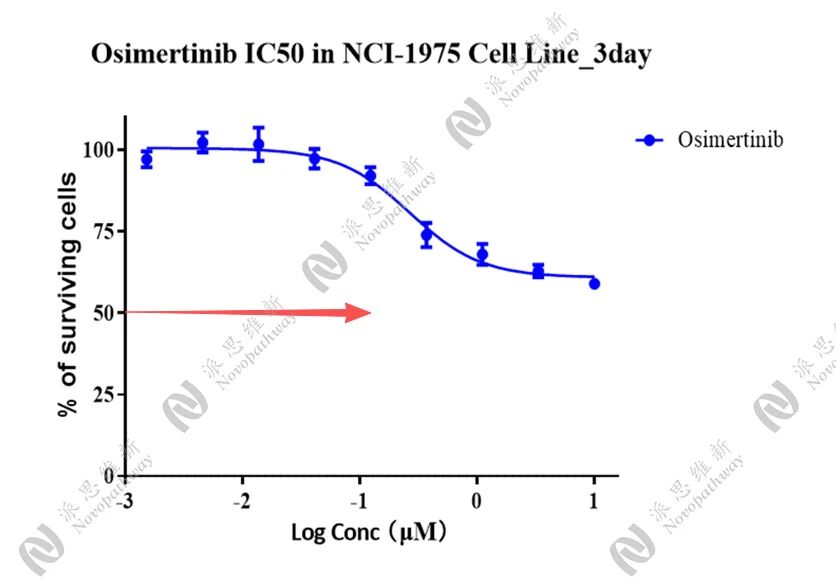
Osimertinb 在 NCI-1975 Cell耐药模型上的效果
此外,EGFR 非依赖性耐药机制还包括组织学转变: NSCLC 转变为小细胞肺癌和上皮‒间质转化;表观遗传调控机制: m6A 和 m5C 修饰可以影响 mRNA 的稳定性和翻译效率,这可能改变与耐药性相关的蛋白质的表达水平,从而影响肿瘤细胞对奥希替尼的耐药性[4]。
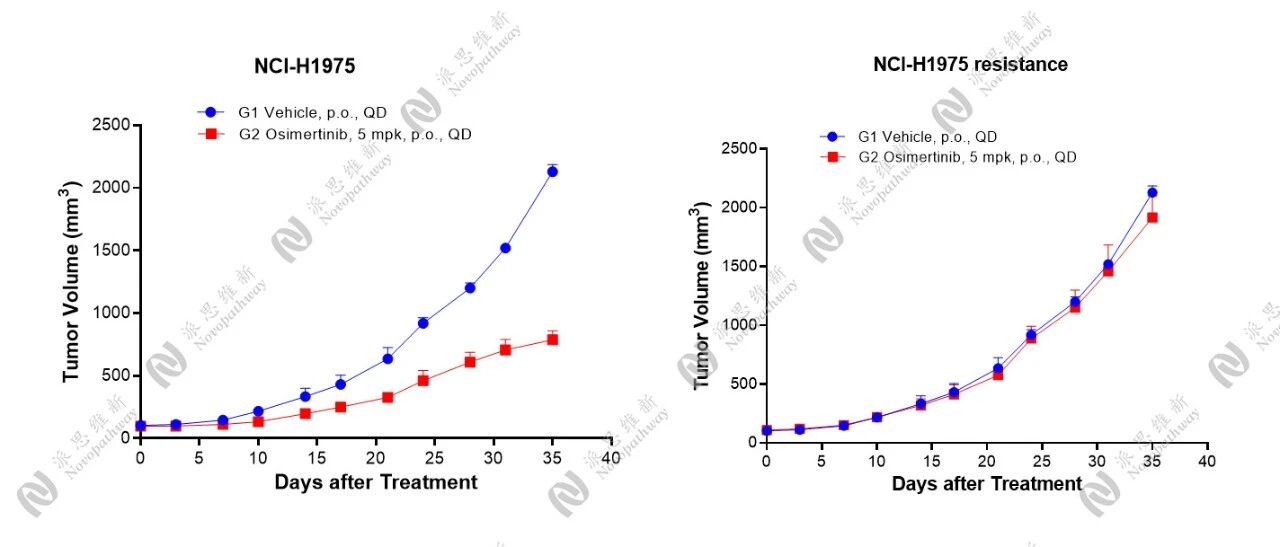
Osimertinb耐药的NCI-H1975 Cell非小细胞肺癌模型
在奥希替尼耐药模型构建方面,我们选择了具有EGFRL858R/T790M突变特征的NCI-H1975人非小细胞肺癌细胞系,通过药物冲击诱导的方式,成功构建了奥希替尼的耐药模型。
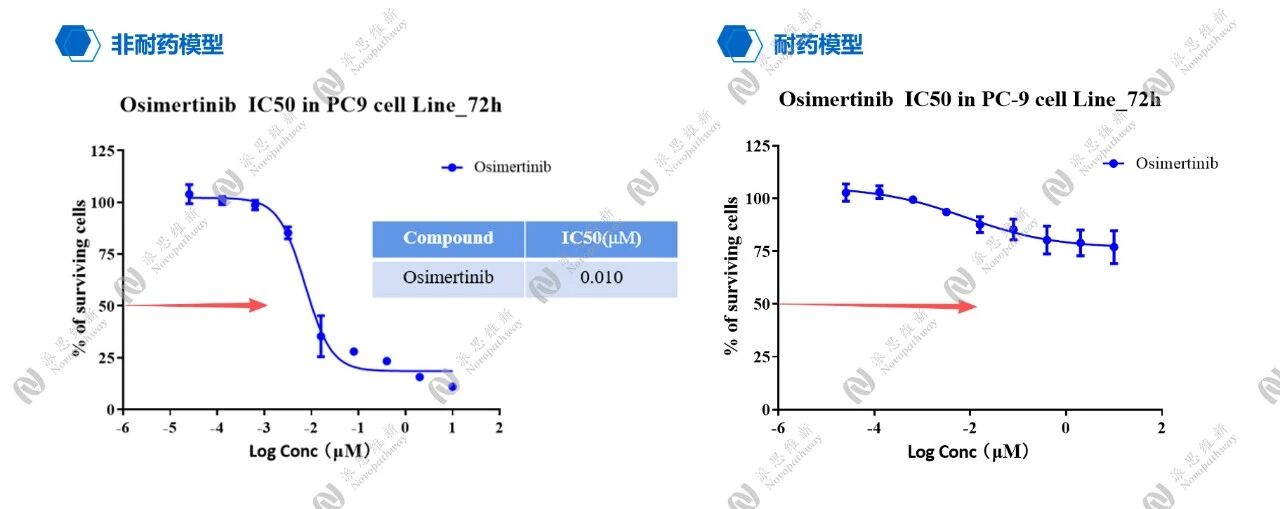
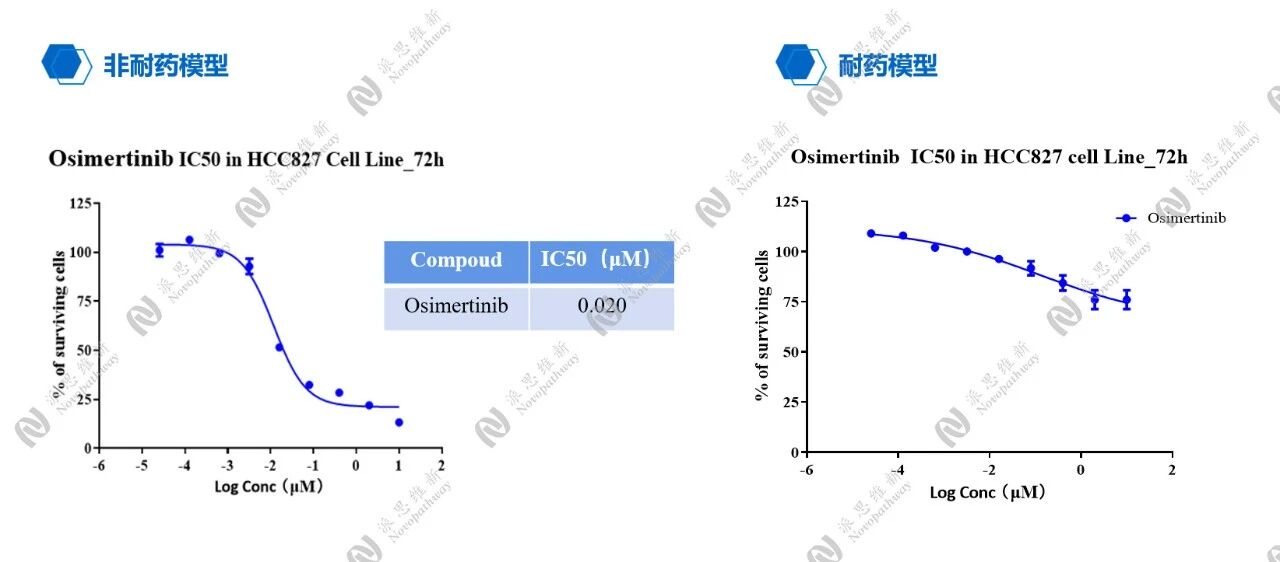
Osimertinb在NCC827 Cell非小细胞肺癌非耐药和耐药模型对比
参考文献
[1] Zhong, L., Li, Y., Xiong, L. et al. Small molecules in targeted cancer therapy: advances, challenges, and future perspectives. Sig Transduct Target Ther 6, 201 (2021).
[2] Amirhossein Rismanbaf. Improving targeted small molecule drugs to overcome chemotherapy resistance. First published: 22 November 2023 https://doi.org/10.1002/cnr2.1945
[3] Josep M. Llovet, M.D., Sergio Ricci,etc.Sorafenib in Advanced Hepatocellular Carcinoma.The new england journal of medicine,2008,359(4):378-390.
[4] The mechanism and response strategies of osimertinib resistance in non-small cell lung cancer LI Pan , TAN Kunming , LV Xinwu , YI Yanmei School of Basic Medicine, Guangdong Medical University, Zhanjiang 524023 , China.
[5] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol. 2012;13(3):239–246. doi: 10.1016/S1470-2045(11)70393-X.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




