- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

肺部感染临床前研究的一站式解决策略
01 前言
在微生物感染的领域中,真菌性肺部感染一直是临床一大难题,其发病隐匿、进展迅速且复杂多变,严重威胁着免疫低下人群的生命健康。无论是院内感染还是社区获得性感染,真菌感染的病死率都居高不下。而上海派思维新生物医药科技有限公司,正以其专业的技术平台和丰富的研发经验,为这一棘手的临床问题提供从体外筛选到体内验证的全链条解决方案。
02 体外筛选:精准评估抗真菌活性
在临床医学领域,真菌性肺部感染是一种具有较高发病率和死亡率的疾病,对患者的健康和生命安全构成了严重威胁。为了更好地应对这一挑战,上海派思维新生物医药科技有限公司凭借其深厚的技术实力和丰富的研发经验,构建了从体外筛选到体内验证的全链条研究方案,旨在为真菌性肺部感染的治疗提供更精准、更有效的解决方案。
体外共培养实验:探索抗真菌药物的初始阵地
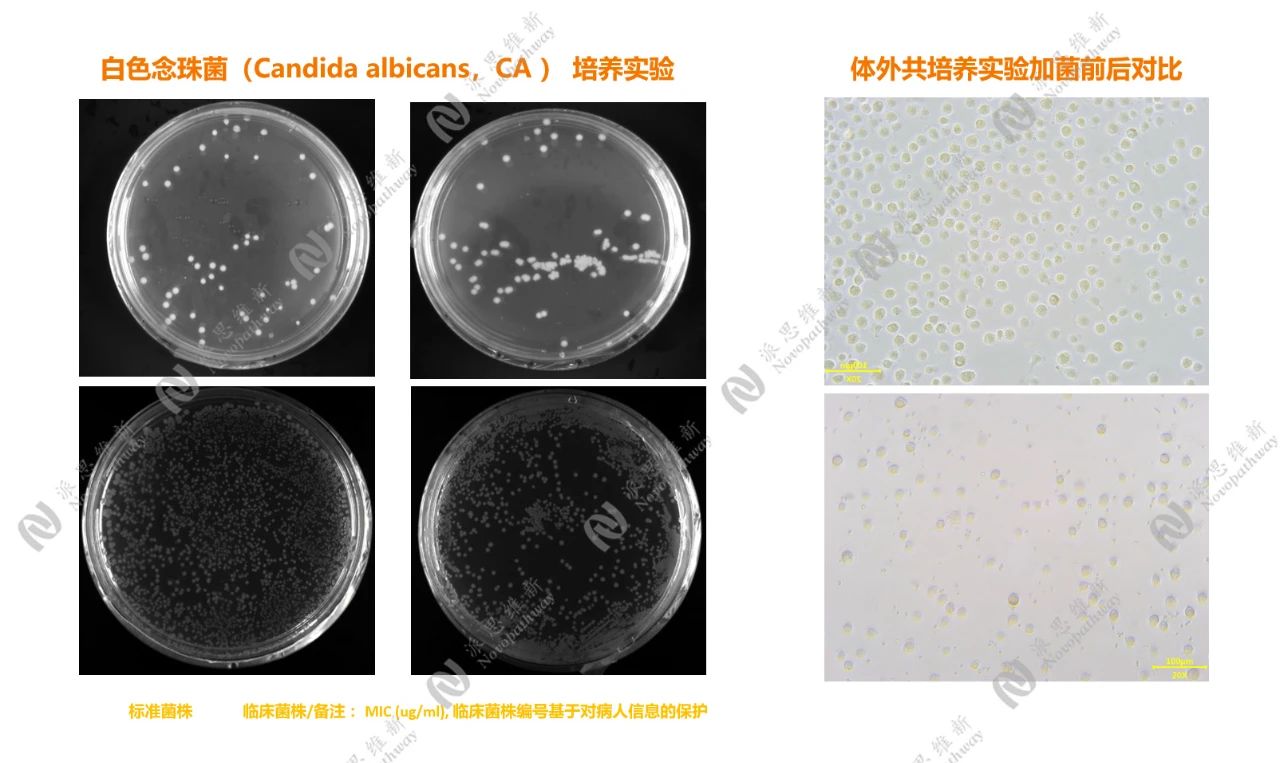
2.1 白色念珠菌的体外共培养实验
真菌性肺部感染在临床上较为常见,其中白色念珠菌(Candida albicans,CA)是主要的致病真菌之一。该真菌在免疫功能低下的患者中易引发严重的肺部感染,导致较高的病死率。随着抗生素的广泛使用,耐药性问题日益突出,开发新型抗真菌药物迫在眉睫。
目前,体外共培养实验是筛选抗真菌药物的常用方法。通过模拟体内感染环境,研究人员可以初步评估药物对真菌生长的抑制作用。然而,现有体外模型在模拟复杂生理环境方面仍存在局限性,难以完全反映药物在体内的真实疗效。
实验流程
在体外共培养实验中,首先将标准菌株和临床菌株的白色念珠菌进行培养。实验中,对临床菌株的 MIC(最低抑制浓度)进行测定,这一指标能够直观地反映药物在体外对真菌的抑制能力。临床菌株编号基于对患者信息的保护,体现了科研伦理的严谨性。
菌株培养:将白色念珠菌标准菌株和临床菌株分别接种于培养基中,37℃培养24小时。
药物处理:将不同浓度的抗真菌药物加入培养基中,与真菌共同孵育。
观察指标:通过肉眼观察和显微镜检查,记录真菌生长情况和形态变化。使用比浊法测定菌液浓度,评估药物对真菌生长的抑制效果。
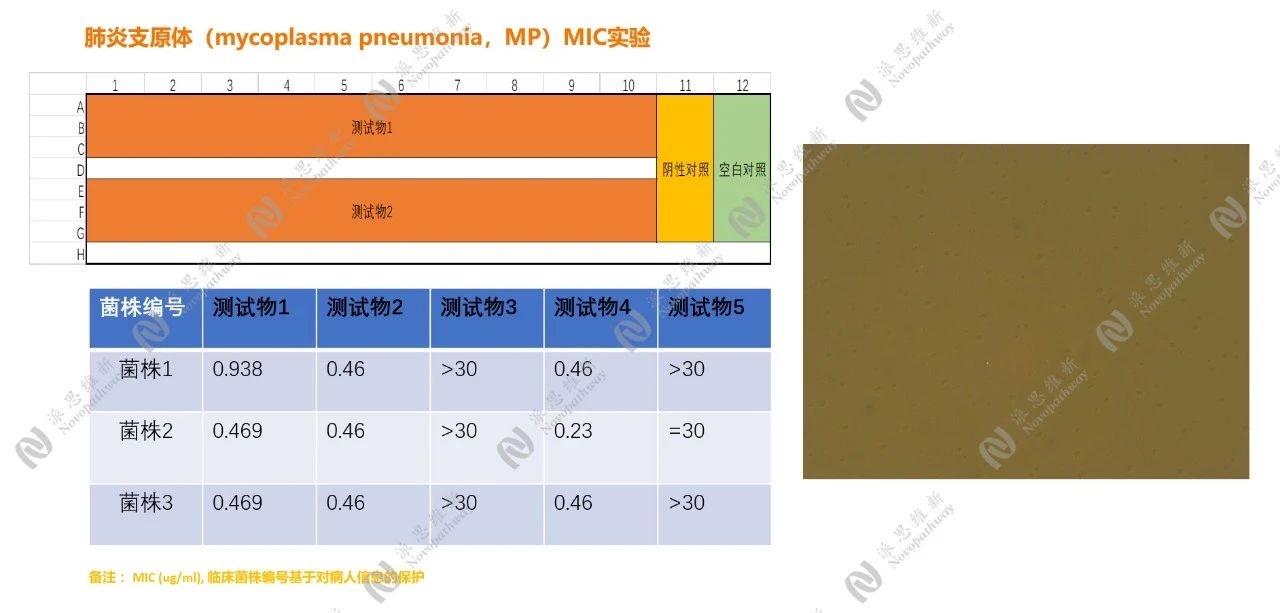
2.2 肺炎支原体的体外共培养实验
肺炎支原体(Mycoplasma pneumoniae,MP)是引起社区获得性肺炎的常见病原体之一。肺炎支原体感染可导致不同程度的肺部炎症和组织损伤,严重时可引发呼吸衰竭等并发症。其感染具有隐匿性和慢性的特点,早期诊断和治疗较为困难。
目前,肺炎支原体感染的治疗主要依靠抗生素,但耐药性问题逐渐凸显。新型抗感染药物和免疫调节剂的研发成为研究热点。体外共培养实验在筛选潜在抗感染药物方面具有重要意义,但现有模型在模拟肺部微环境和长期感染方面仍需优化。
实验流程:
在体外共培养实验中,首先将肺炎支原体标准菌株和临床菌株进行培养。实验中,对临床菌株的 MIC(最低抑制浓度)进行测定,以评估药物在体外对肺炎支原体的抑制能力。临床菌株编号基于对患者信息的保护,体现了科研伦理的严谨性。
菌株培养:将肺炎支原体标准菌株和临床菌株分别接种于专用培养基中,37℃培养14天。
药物处理:将不同浓度的抗感染药物加入培养基中,与肺炎支原体共同孵育。
观察指标:通过q-PCR检测支原体DNA拷贝数,评估药物对支原体增殖的抑制效果;同时,观察细胞形态变化和培养基的浑浊度,记录药物对支原体生长的影响。
03 体内认证:派思维新肺炎动物模型
体外实验的成功只是迈出了第一步,体内验证才是验证药物疗效的关键环节。派思维新构建了一系列肺部真菌感染动物模型,用于评估药物在体内的抗感染效果。
体内验证的关键:肺炎实验动物模型
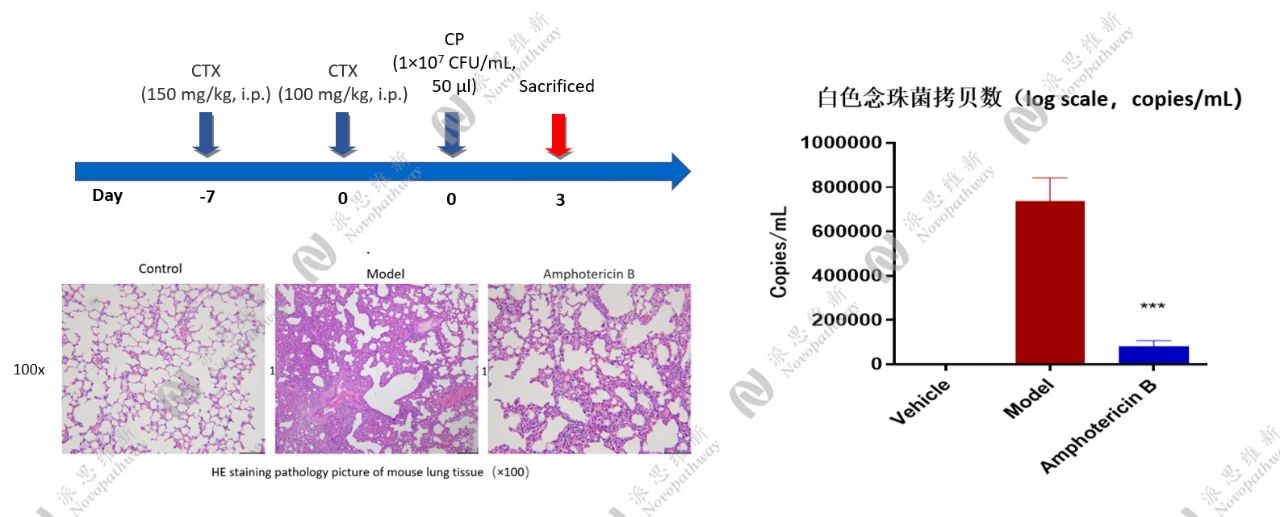
3.1 白色念珠菌感染小鼠肺部模型
白色念珠菌感染是临床常见的真菌性肺部疾病,尤其在免疫抑制患者中具有较高的发病率和死亡率。尽管现有抗真菌药物能够一定程度上控制感染,但药物耐受性和副作用问题依然存在,仍需开发更为有效且安全的治疗方案。
目前,体内模型是评估抗真菌药物疗效的重要工具。通过模拟人类感染过程,研究人员能够在接近生理环境的条件下,深入研究药物的作用机制和疗效。然而,现有模型在感染剂量、给药方案和监测指标等方面仍存在优化空间。
实验流程:
免疫抑制处理:实验小鼠在接种前先给予环磷酰胺进行免疫抑制,模拟人体免疫功能低下时易发真菌感染的情况。
感染模型建立:通过特定的感染方式,使小鼠感染白色念珠菌。在感染当天开始给药,每天一次,连续给药三天。
监测指标:每天密切监测动物的临床状态和体重变化,这是评估药物安全性和动物耐受性的重要指标。感染72小时后,安乐死解剖小鼠,取支气管肺泡灌洗液(BALF)和肺组织。
样本分析:采用q-PCR法检测BALF中白色念珠菌DNA拷贝数,该方法具有高灵敏度和特异性,能够准确定量真菌负荷。同时,对肺组织进行病理染色(H&E)分析,观察肺部组织的病理变化。
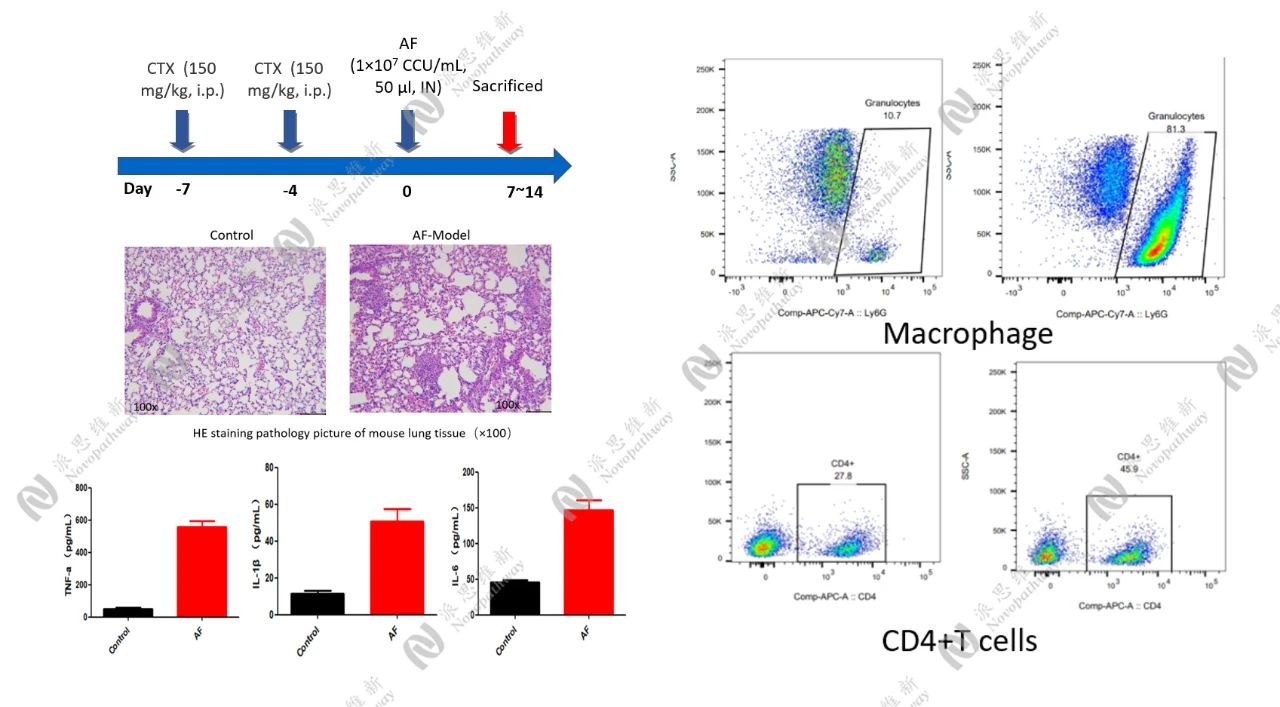
3.2 肺曲霉菌感染模型:探索新型抗真菌疗法
肺曲霉菌感染(Aspergillus fumigatus,AF)是另一种常见的真菌性肺部疾病,尤其在免疫抑制宿主中具有较高的发病率和死亡率。曲霉菌具有较强的致病性和耐药性,给临床治疗带来巨大挑战。
目前,肺曲霉菌感染的治疗主要依赖于有限的抗真菌药物,且耐药性问题日益严重。新型抗真菌药物的研发和现有药物的联合治疗策略成为当前研究的热点。体内模型在评估药物疗效和机制研究方面发挥着关键作用,但仍需进一步优化模型的稳定性和重复性。
实验流程
免疫抑制处理:实验小鼠在接种前给予环磷酰胺进行免疫抑制处理,以模拟免疫功能低下的状态。
感染模型建立:通过滴鼻攻毒的方式使小鼠感染肺曲霉菌。在攻毒后,每天监测动物的临床状态和体重变化。
给药方案:在感染后的特定时间开始给药,每天一次,连续给药三天。
样本收集与分析:攻毒观察7至14天后,安乐死解剖小鼠,取血清、BALF和肺组织。采用q-PCR法检测BALF中真菌拷贝数和炎症细胞因子水平,对肺组织进行病理染色(H&E)分析。
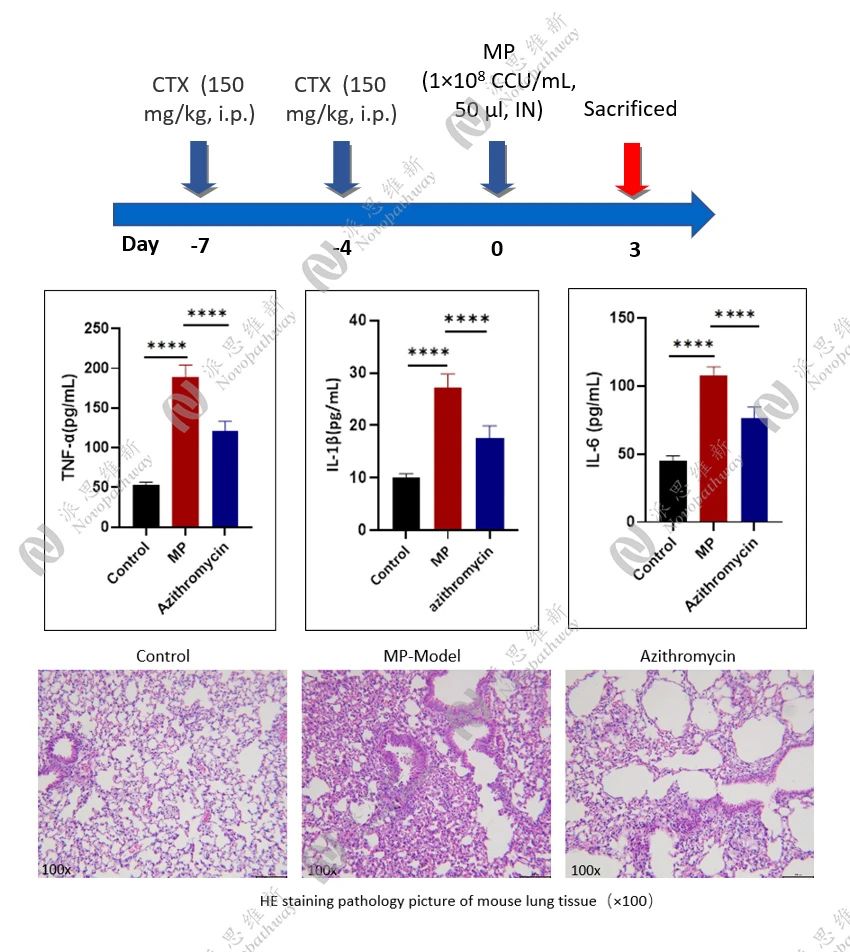
3.3 肺炎支原体感染小鼠模型:评估药物对支原体感染的疗效
肺炎支原体(Mycoplasma pneumoniae,MP)是引起社区获得性肺炎的常见病原体之一。肺炎支原体感染可导致不同程度的肺部炎症和组织损伤,严重时可引发呼吸衰竭等并发症。
目前,肺炎支原体感染的治疗主要依靠抗生素,但耐药性问题逐渐凸显。新型抗感染药物和免疫调节剂的研发成为研究热点。体内模型在评估药物疗效和安全性方面具有重要意义,但现有模型在感染剂量和给药方案等方面仍需优化。
实验流程:
免疫抑制处理:实验小鼠在接种前给予环磷酰胺进行免疫抑制处理。
感染模型建立:通过滴鼻攻毒的方式使小鼠感染肺炎支原体。在感染后的2小时开始给药,每天一次,连续给药三天。
监测指标:每天监测动物的临床状态和体重变化。感染3天后,安乐死解剖小鼠,取BALF和肺组织。
样本分析:采用q-PCR法检测BALF中病毒载量和炎症细胞因子水平,对肺组织进行病理染色(H&E)分析。
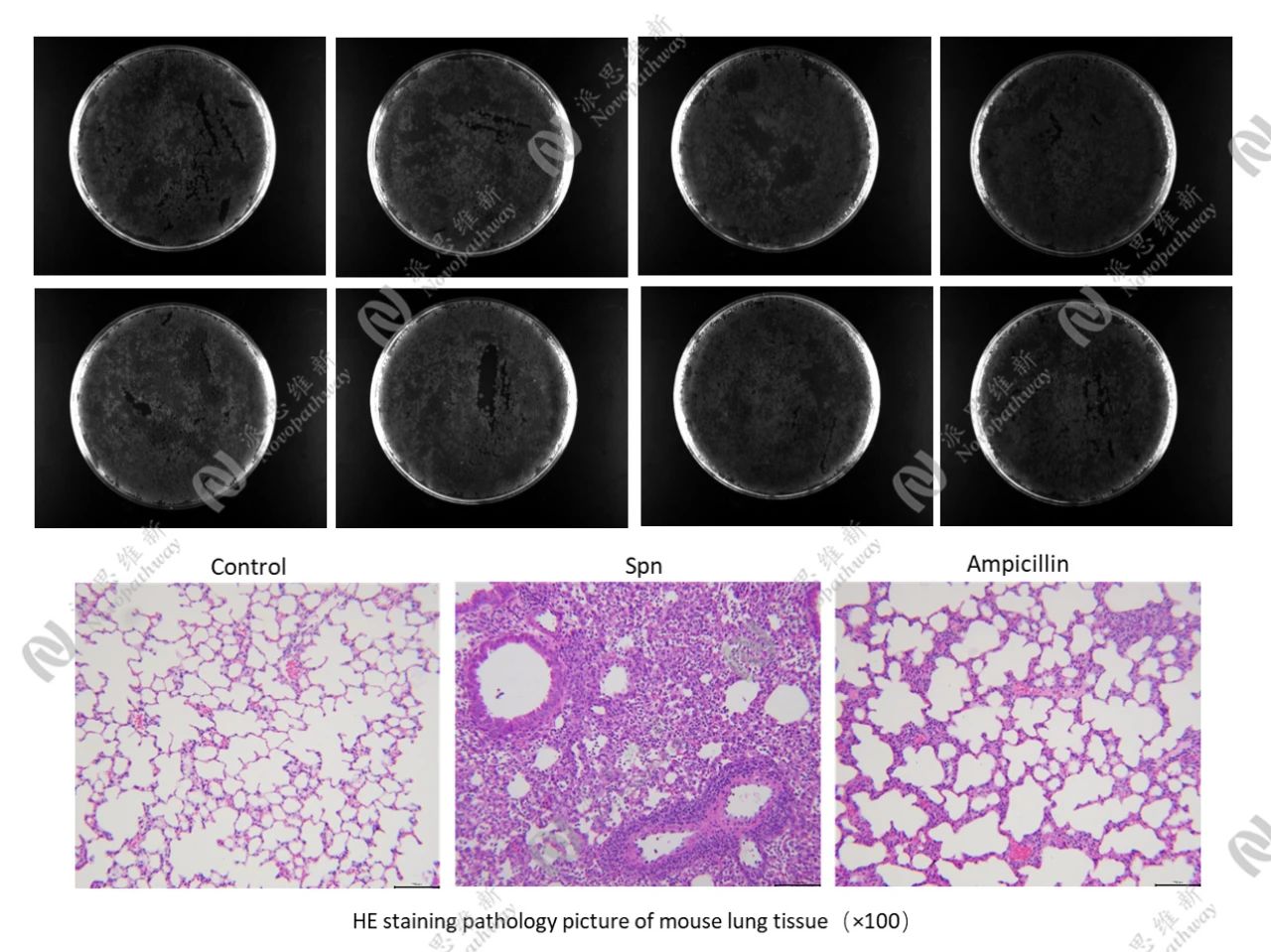
3.4 肺炎链球菌感染小鼠模型:评估抗菌药物的体内疗效
肺炎链球菌(Streptococcus pneumoniae,Spn)是社区获得性肺炎的常见病原体之一。肺炎链球菌感染可导致肺部炎症、组织损伤,严重时可引发菌血症、败血症等并发症,对患者的生命健康构成严重威胁。
目前,临床常用的抗菌药物包括 β-内酰胺类抗生素(如青霉素、头孢菌素等)、大环内酯类抗生素(如阿奇霉素)等。然而,随着抗生素的广泛使用,肺炎链球菌的耐药性问题日益严重,给临床治疗带来了巨大挑战。因此,开发新型抗菌药物和优化现有治疗方案成为研究热点。体内感染模型在评估抗菌药物疗效方面具有重要意义,能够为新药研发提供关键数据支持。
实验流程
通过滴鼻攻毒构建小鼠肺炎链球菌感染模型(1×10⁹ CFU/mL,50 μL),在感染后的 2 h 开始给药,每天一次,连续给药3天。攻毒后,每天监测动物临床状态和体重,直至试验终点。攻毒3天后,安乐死解剖小鼠,取BALF 和肺组织。对BALF进行平板涂布,测定菌落形成单位(CFU),以评估药物对肺炎链球菌的抑制效果。同时,对肺组织进行病理染色(H&E)分析,观察肺部组织的病理变化,直观地评估药物对感染引起的组织损伤的改善情况。
3.5 基于动物模型的药效评价
在这些精心构建的动物模型基础上,派思维新能够对药物的药效进行全面评价。通过比较不同处理组之间的真菌载量、炎症反应和组织病理变化,可以直观地判断药物的抗感染效果。例如,在白色念珠菌感染模型中,药物治疗组的BALF中白色念珠菌DNA拷贝数显著低于模型对照组,表明药物能够有效抑制真菌的生长和繁殖。同时,肺组织病理染色结果显示,药物治疗组的肺组织损伤程度明显减轻,炎症细胞浸润减少,进一步证实了药物的保护作用。
此外,对于免疫抑制状态下的真菌感染,动物模型还能帮助研究人员了解药物对宿主免疫系统的影响。通过监测外周血中的免疫细胞数量和功能变化,可以评估药物是否具有免疫调节作用,从而为临床应用提供更全面的参考信息。
参考文献
[1] 陈灏珠, 林果为, 王吉耀. 实验室检查正常值与临床意义手册 [M]. 上海: 上海科学技术文献出版社, 2010.
[2] 钟力生. 真菌病学 [M]. 北京: 人民卫生出版社, 2007.
[3] 周庭银. 临床微生物学检验 [M]. 南京: 东南大学出版社, 2012.
[4] 李家涛, 张石革, 周康荣. 医学分子生物学 [M]. 北京: 人民卫生出版社, 2017.
[5] 赵扬玉, 李莉, 刘志红. 肾脏病学 [M]. 北京: 人民卫生出版社, 2014.
[6] 王鸿利, 徐根波. 血液病学 [M]. 上海: 上海科学技术出版社, 2013.
[7] 李兰娟, 任勇. 传染病学 [M]. 北京: 人民卫生出版社, 2018.
[8] 王辰. 呼吸病学 [M]. 北京: 人民卫生出版社, 2017.
[9] 《Infection and Immunity》杂志中,关于肺炎链球菌感染小鼠模型构建及药物疗效评估的研究论文。
[10] 《Antimicrobial Agents and Chemotherapy》期刊上,探讨新型抗菌药物对肺炎链球菌感染治疗效果的相关文献
[11] 陈灏珠, 林果为, 王吉耀. 实验室检查正常值与临床意义手册 [M]. 上海: 上海科学技术文献出版社, 2010.
[12] 钟力生. 真菌病学 [M]. 北京: 人民卫生出版社, 2007.
[13] 李兰娟, 任勇. 传染病学 [M]. 北京: 人民卫生出版社, 2018.
[14] 王辰. 呼吸病学 [M]. 北京: 人民卫生出版社, 2017
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




