- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

慢性阻塞性肺病(COPD)全维度研究
01 前言
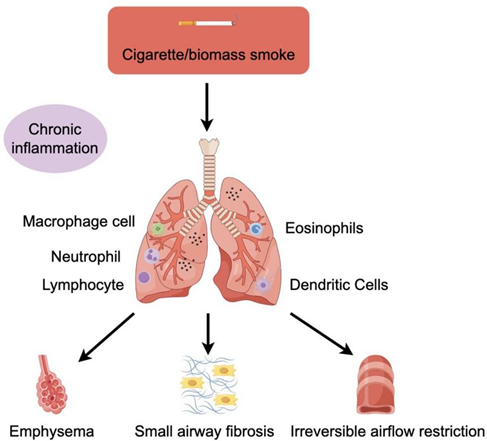
慢性阻塞性肺病(COPD)是一种慢性呼吸系统疾病,慢性呼吸系统疾病被WHO定义为影响人类健康的四大慢性疾病之一[1],包括慢性支气管炎、肺气肿和小气道阻塞,对人体健康构成了严重威胁,显著影响患者生活质量[2]。不完全可逆的气流受限、炎症、粘液分泌过多和支气管粘膜上皮病变是该病的主要病理基础。
1.1 流行病学
COPD的患病率受地区、年龄、性别影响较大。在《柳叶刀》2018年的一项报道中显示,中国20岁及以上成人的COPD患病率为8.6%,预计在2015年,中国20岁及以上成人COPD患者能达到百万人。报道中显示,男性患病率为11.9%,女性患病率为5.4%,男性明显高于女性,这可能与吸烟史有关。20岁以上患病率为2.1%,而大于40岁人群的COPD患病率为13.7%,明显高于20-39岁人群[5]。受累于吸烟率,中国的 COPD 死亡率正呈上升趋势。到 2030 年这一比例可能达到 33%[6]。
1.2 病因及发病机制
COPD发作由基因与环境因素共同导致,与烟草烟雾、二手烟暴露、室内外空气污染、职业暴露、生物质烟雾、遗传因素、长期哮喘、饮食和结核病等因素相关,一般认为烟草是最主要的因素[2],不过值得注意的是,随着社会发展及环境变化,非吸烟者的患病概率也在增加,根据美国胸科学协会社区调查显示,30%的COPD患者从未吸烟[7]。COPD由慢性支气管炎和肺气肿进一步发展而来,发展为不可逆的持续性气流受限,这是慢阻肺的标志。上皮细胞及多种炎症细胞共同介导慢阻肺的发生,其结果主要包括上皮屏障纤维化致功能受损、肺泡壁破坏、肺部腺体粘液分泌增加。
持续炎症导致气道壁胶原沉积(Ⅰ型胶原增加 60%,Ⅲ型胶原增加 40%),同时肺泡间隔弹性纤维断裂,肺弹性回缩力下降 50% 以上。这种结构改变使气道闭合容积增加,呼气时气道过早塌陷,形成特征性气流受限。气流受限程度是一种客观的、重复性良好的诊断和评价慢阻肺的指标。
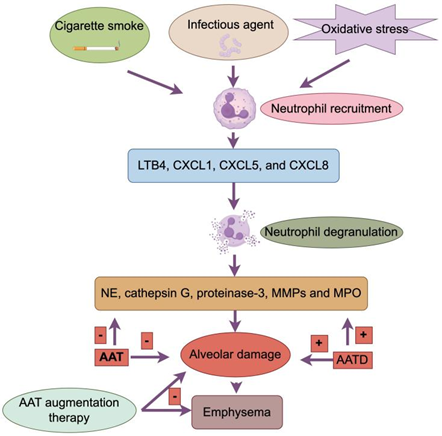
氧化应激是导致COPD 的重要一个因素。以香烟为例,香烟烟雾每支含 10^15^ 个自由基,主要为超氧阴离子与羟基自由基[8]。这些活性氧(ROS),引发黏液高分泌,而过多的粘液分泌和中性粒细胞的积累又会产生大量的活性氧(ROS)。ROS会导致抗蛋白酶失活,抗蛋白酶对蛋白酶具有抑制作用,其中α1-抗胰蛋白酶(α1-AT)是活性最强的一种,在由蛋白酶-抗蛋白酶失衡引起的肺组织结构破坏中,α1-AT失活是最关键的。ROS 可氧化α1-AT活性位点,使其与弹性蛋白酶结合能力大幅度降低,加剧蛋白酶失衡。在2000年发表于《美国呼吸与危重症医学杂志》(American Journal of Respiratory and Critical Care Medicine)的一项研究中显示,COPD 患者呼出气冷凝物中8-异前列腺素 F2α(氧化应激标志物)水平较正常人升高 2-3 倍。
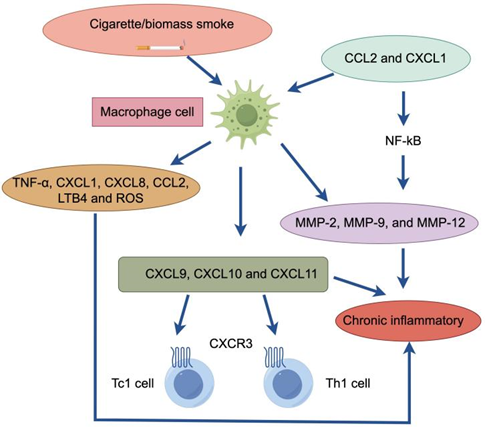
慢性炎症在COPD的发生和发展中起着重要作用,主要影响肺实质和周围气道。这种慢性炎症的特征是巨噬细胞、淋巴细胞和中性粒细胞数量增加。巨噬细胞与中性粒细胞在COPD患者的慢性炎症中起重要作用。受氧化应激影响,中性粒细胞大量募集于气道,释放属于丝氨酸蛋白酶的基质金属蛋白酶(MMP)与中性粒细胞弹性蛋白酶(NE),破坏的肺泡组织,重塑气道。中性粒细胞的免疫反应是氧化应激的诱因,中性粒细胞对于感染的刺激十分敏感,在COPD患者受到感染刺激后,中性粒细胞聚集并吞噬感染源,释放蛋白酶保护细胞和组织,但同时也产生了ROS。巨噬细胞也会聚集在肺泡壁受损部位,且肺气肿的程度与巨噬细胞的数量相关,巨噬细胞在受到激活后释放大量炎症因子,介导炎症反应,在COPD患者的BALF中常常可以检测到大量的巨噬细胞,和与其相应的趋化因子CCL2和CXCL1[9]。
在部分患者体内,嗜酸性粒细胞、辅助性 T 细胞 2(Th2 细胞)或 2 型固有淋巴细胞(ILC2)的数量可能出现增多。这些细胞能够与上皮细胞、内皮细胞等结构细胞相互作用,共同释放多种炎症介质,参与炎症反应的调控过程。
doi: 10.3389/fimmu.2024.1404615. PMID: 39185405; PMCID: PMC11341368.
02 COPD动物模型
2.1 COPD小鼠模型
动物模型的构建与应用是疾病研究领域的重要技术手段,准确有效的动物模型构建为解析疾病发病机制、筛选潜在治疗药物提供了关键支撑。当前,多种动物模型已被广泛应用于慢性阻塞性肺疾病(COPD)的病因探索、发病机制阐明、新型治疗靶点发现及新疗法疗效评估等研究中,为该疾病的基础与转化医学研究奠定了重要基础。使用烟草烟雾、脂多糖、弹性蛋白酶、免疫诱导是常用的COPD动物模型造模方式,模型的基本特征包括气腔扩大、粘液分泌增多、慢性炎症和气道重塑。理想情况下,COPD动物模型会表现出和人类似的COPD特征,但仍具有局限性,在选择COPD模型时,应注意不同模型之间的差异。由于人类和啮齿类动物在基因上有许多相似之处,因此小鼠和大鼠被广泛用于研究人类的呼吸系统疾病研究。
香烟烟雾诱导小鼠模型
方法:SPF 级 C57BL/6J 雄性小鼠(体重20-22g),将小鼠置于烟熏箱内,每日用 5-10 支香烟烟熏 30-60 分钟,每周持续 5-7 天,造模周期为 8-12 周。
原理:香烟烟雾中的尼古丁、焦油等有害成分可诱导气道炎症、黏液分泌增加及肺组织损伤,模拟人类长期吸烟导致的 COPD 病理生理过程。
优缺点:操作相对简单,能较好地复现吸烟相关 COPD 的发病机制,是最常用的造模方法之一。但是烟雾浓度和成分难以精确控制,不同品牌香烟成分存在差异,且造模周期较长。
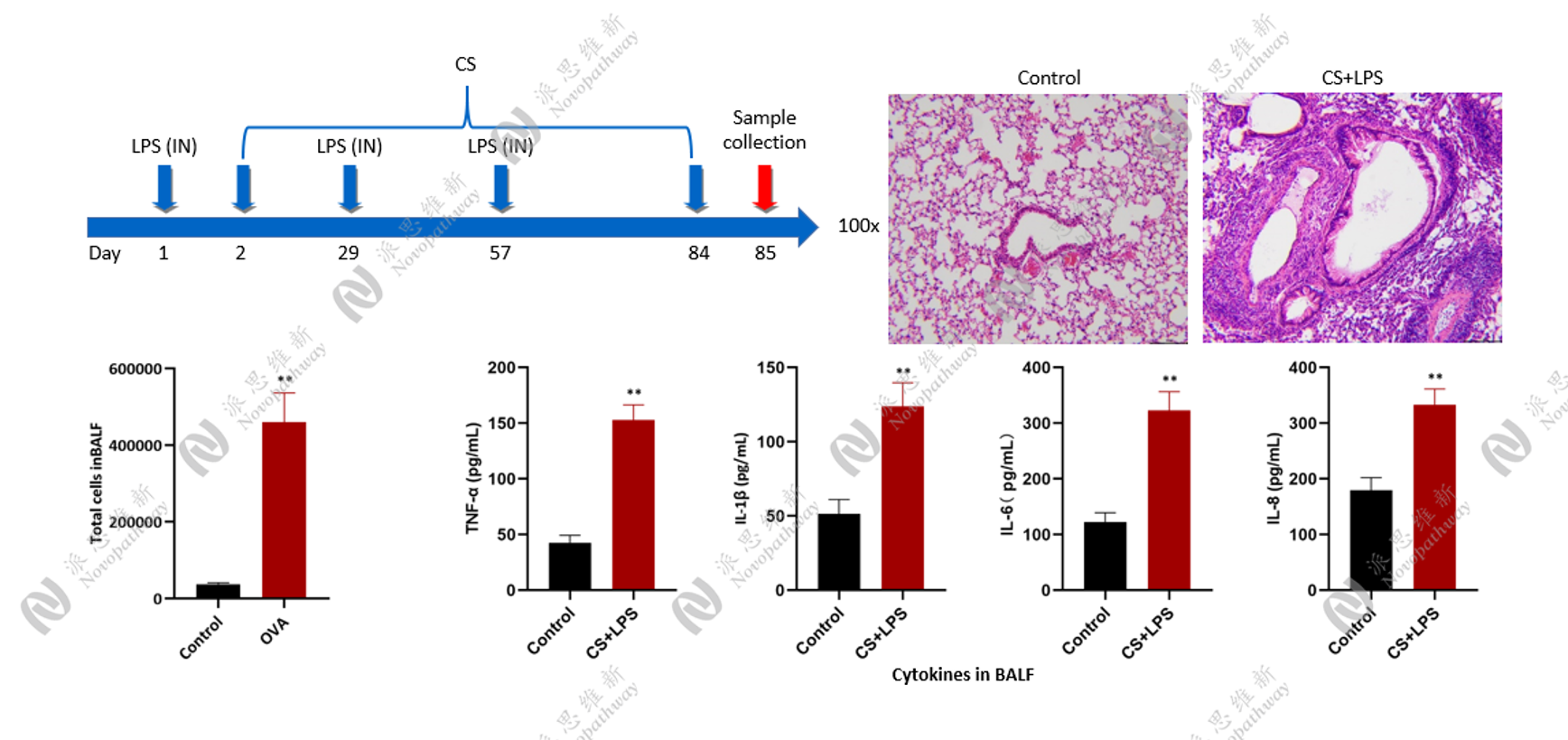
脂多糖(LPS)联合香烟烟雾诱导小鼠模型
方法:SPF 级 C57BL/6J 雄性小鼠(体重20-22g),先采用香烟烟雾暴露法处理小鼠,同时在特定时间点(如第1天、第14天)经鼻腔滴入 50~100μg LPS。
原理:LPS 可激活炎症细胞,引发肺部炎症反应,与香烟烟雾的损伤作用协同,加速并加重肺部炎症及组织破坏,更贴近人类 COPD 的复杂病理过程。
优缺点:能在较短时间内诱导出更显著的肺部炎症和肺功能改变,提高模型的成功率与稳定性。需要注意的是,LPS剂量需严格控制,避免小鼠过度炎症反应或导致死亡。
2.2 COPD大鼠模型
大鼠也常被用于研究呼吸系统,使用大鼠的优势之一是能在烟草烟雾暴露 3 至 6 个月内产生类似肺气肿的损伤。大鼠还模拟人类的慢性支气管炎特点。在长期暴露于烟草烟雾后,大鼠会出现人类COPD常见的粘液变性。与小鼠造模方法类似,大鼠模型包括脂多糖诱导法(LPS)[13]、脂多糖联合香烟烟雾诱导法[14]、香烟烟雾诱导法[15]。
脂多糖(LPS)联合香烟烟雾诱导大鼠模型
方法:每次持续吸入新鲜香烟烟雾30 min,每日2次,持续数周至数月,于第1、15天在麻醉状态下经鼻给予造模大鼠脂多糖200μL,滴注日不进行烟熏处理。
原理:烟雾刺激使大鼠肺部氧化应激,结合LPS造成的肺部损伤,诱发肺功能下降、肺气肿、小气道重塑,模拟COPD的典型特征。
香烟烟雾诱导大鼠模型
方法:SPF雄性SD大鼠,至于烟熏箱中,使用香烟燃烧发生器每次点燃10根香烟,并将烟雾浓度维持在6%-8%,每天两次,每次30~45min,每周5~6天,持续12周以上。
原理:利用烟雾中的有害化学物质(如尼古丁、焦油、一氧化碳等)引起肺部炎症反应、气道上皮损伤、黏液分泌增加以及肺组织结构的破坏,进而导致慢性阻塞性肺疾病的病理改变和肺功能下降,模拟人类长期吸烟导致的COPD病理过程。


03 药物治疗方案
COPD的治疗旨在缓解症状、延缓病情进展、改善生活质量,药物治疗可以缓解慢阻肺的症状。
支气管舒张剂是COPD常用治疗药物,可以松弛气道平滑肌细胞,缓解气道痉挛,扩张支气管,改善气流受限。相较于口服制剂,吸入给药途径可使药物直接作用于靶器官,显著提高局部药物浓度,同时减少全身不良反应,因而成为临床首选给药方式。
目前临床常用支气管舒张剂主要包括β₂受体激动剂、抗胆碱能药物及甲基黄嘌呤类。β₂受体激动剂通过激活气道平滑肌细胞膜上的β₂肾上腺素能受体,增加细胞内环磷酸腺苷(cAMP)浓度,介导平滑肌舒张;抗胆碱能药物则通过竞争性拮抗M胆碱受体,阻断乙酰胆碱介导的气道收缩;甲基黄嘌呤类药物可通过抑制磷酸二酯酶,减少cAMP降解,从而舒张支气管。
糖皮质激素适用于中重度COPD患者,尤其合并频繁急性加重者。吸入性糖皮质激素(如布地奈德、氟替卡松)可抑制气道炎症细胞的活化和迁移,降低炎症介质释放;急性加重期常需系统性使用糖皮质激素(如泼尼松龙),通过调节NF-κB等炎症信号通路,快速缓解临床症状,但需警惕长期使用带来的骨质疏松、感染风险增加等不良反应[16]。
COPD的治疗也包括抑制肺部炎症和祛痰治疗,磷酸二酯酶-4抑制剂(如罗氟司特)可选择性抑制气道炎症细胞内的磷酸二酯酶-4,升高cAMP水平,减少炎症介质释放,适用于存在慢性支气管炎表型且频繁急性加重的患者;黏液溶解剂(如氨溴索、N-乙酰半胱氨酸)通过降低痰液黏稠度,缓解气道阻塞[16]。
[1]Martinez FJ, Agusti A, Celli BR, Han MK, Allinson JP, Bhatt SP, Calverley P, Chotirmall SH, Chowdhury B, Darken P, Da Silva CA, Donaldson G, Dorinsky P, Dransfield M, Faner R, Halpin DM, Jones P, Krishnan JA, Locantore N, Martinez FD, Mullerova H, Price D, Rabe KF, Reisner C, Singh D, Vestbo J, Vogelmeier CF, Wise RA, Tal-Singer R, Wedzicha JA. Treatment Trials in Young Patients with Chronic Obstructive Pulmonary Disease and Pre-Chronic Obstructive Pulmonary Disease Patients: Time to Move Forward. Am J Respir Crit Care Med. 2022 Feb 1;205(3):275-287. doi: 10.1164/rccm.202107-1663SO. PMID: 34672872; PMCID: PMC8886994.
[2]中华医学会,中华医学会杂志社,中华医学会全科医学分会,等. 中国慢性阻塞性肺疾病基层诊疗与管理指南(2024年)[J]. 中华全科医师杂志,2024,23(06):578-602.
DOI:10.3760/cma.j.cn114798-20240326-00174
[3]WHO. The Top 10 Causes of Death. Published by World Health Organization (WHO). 9 December 2020. Available online: https:
//www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (accessed on 28 June 2021).
[4]Durham, A.L.; Adcock, I.M. The relationship between COPD and lung cancer. Lung Cancer 2015, 90, 121–127.
[5]Wang C, Xu J, Yang L, et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross‑sectional study[J]. Lancet, 2018, 391(10131):1706‑1717. DOI: 10.1016/S0140‑6736(18)30841‑9.
[6] Niu, S.R.; Yang, G.H.; Chen, Z.M.; Wang, J.L.; Wang, G.H.; He, X.Z.; Schoepff, H.; Boreham, J.; Pan, H.C.; Peto, R. Emerging tobacco hazards in China: 2. Early mortality results from a prospective study. BMJ 1998, 317, 1423–1424.
[7]Eisner MD, Anthonisen N, Coultas D, Kuenzli N, Perez-Padilla R, Postma D, Romieu I, Silverman EK, Balmes JR. Committee on nonsmoking COPD, environmental and occupational health assembly. An official American Thoracic Society public policy statement: novel risk factors and the global burden of chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2011; 182: 693–718.
[8]Szalontai K, Gémes N, Furák J, Varga T, Neuperger P, Balog JÁ, Puskás LG, Szebeni GJ. Chronic Obstructive Pulmonary Disease: Epidemiology, Biomarkers, and Paving the Way to Lung Cancer. J Clin Med. 2021 Jun 29;10(13):2889. doi: 10.3390/jcm10132889. PMID: 34209651; PMCID: PMC8268950.
[9]Xu J, Zeng Q, Li S, Su Q, Fan H. Inflammation mechanism and research progress of COPD. Front Immunol. 2024 Aug 9;15:1404615. doi: 10.3389/fimmu.2024.1404615. PMID: 39185405; PMCID: PMC11341368.
[10]Kahnert K, Jörres RA, Behr J, Welte T. The Diagnosis and Treatment of COPD and Its Comorbidities. Dtsch Arztebl Int. 2023 Jun 23;120(25):434-444. doi: 10.3238/arztebl.m2023.027. PMID: 36794439; PMCID: PMC10478768.
[11]Mano Y, Tsukamoto M, Wang KY, Nabeshima T, Kosugi K, Tajima T, Yamanaka Y, Suzuki H, Kawasaki M, Nakamura E, Zhou Q, Azuma K, Nakashima T, Tamura Y, Kozaki K, Nakazato K, Li YS, Kawai K, Yatera K, and Sakai A. 2022. Oxidative stress causes muscle structural alterations via p38 MAPK signaling in COPD mouse model. J Bone Miner Metab 40: 927–939.
[12]Pelgrim CE, Wang L, Peralta Marzal LN, Korver S, van Ark I, Leusink-Muis T, Braber S, Folkerts G, Garssen J, van Helvoort A, and Kraneveld AD 2022. Increased exploration and hyperlocomotion in a cigarette smoke and LPS-induced murine model of COPD: Linking pulmonary and systemic inflammation with the brain. Am J Physiol Lung Cell Mol Physiol 323: L251–L265.
[13]王鹏雁,蒋明,王昌明,韩旭惠,李璐.脂多糖诱导下慢性阻塞性肺疾病大鼠模型远端肺动脉平滑肌细胞中Toll样受体4表达情况研究[J].中国全科医学,2017,20(21):2603-2608.
[14]14王玮.香烟联合脂多糖建立慢性阻塞性肺疾病大鼠模型[J].中华中医药杂志,2018,(9):3866-3871.
[15]张丹,曹丽华,王镇山,徐明韬,李孟露,冯浩珅,才旭,于娜,康健.红景天苷对香烟烟雾诱导的慢性阻塞性肺疾病大鼠骨骼肌功能影响的研究[J].大连医科大学学报,2019,v.41(03):199-204+209.
[16]Venkatesan P. GOLD COPD report: 2024 update. Lancet Respir Med. 2024 Jan;12(1):15-16. doi: 10.1016/S2213-2600(23)00461-7. Epub 2023 Dec 4. PMID: 38061380.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




