- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

哮喘研究新趋势:OVA致敏小鼠模型的优势在哪?
01 关于哮喘
哮喘简介
支气管哮喘(bronchial asthma,简称哮喘)是一种以慢性气道炎症为特征的呼吸道疾病。典型症状包括反复发作的喘息、气急、胸闷和咳嗽。部分患者还可能伴随发热、咽痛咽痒、乏力或下肢水肿等症状。病情严重时可导致呼吸困难甚至低氧血症。其特征包括气道高反应性、黏液过度分泌、嗜酸性粒细胞浸润和特异性免疫球蛋白E(IgE)的产生,且随病程的延长可进一步引发气道结构改变,即气道重塑[1][2]。作为全球患病率最高的慢性气道疾病之一,哮喘具有病程长、共患病多等特点,严重影响患者生活质量,且目前尚无法治愈。流行病学数据显示,全球受哮喘影响人数约3亿;中国成人患者约4570万,其中约40%的患者病情未得到有效控制,且哮喘发病率在全球范围内仍呈持续上升趋势[3]。
病因和发病机制
哮喘是一种复杂的疾病其病因涉及遗传倾向、环境过敏原暴露和免疫系统异常激活之间的相互作用。目前,哮喘的发病机制尚未完全阐明,但通常涉及免疫反应、气道炎症、气道高反应性及神经机制等四个方面。哮喘的临床表现复杂多样,其病理机制各异,表型也不尽相同。
主要分类
根据主导的炎症细胞类型以及痰细胞分化的比率,哮喘主要分为两种内型:Th2型高炎症型哮喘 (Th2-High Asthma-嗜酸性粒细胞性)和非Th2型/Th2型低炎症型哮喘(Non-Th2/Th2-Low Asthma-中性粒细胞性)[4]。
嗜酸性粒细胞性哮喘[5]:是一种以气道嗜酸性粒细胞浸润为标志的严重哮喘亚型。本质为Th2型免疫反应过度激活导致的慢性气道炎症。其发病机制主要涉及Th2淋巴细胞和M2极化巨噬细胞,二者通过释放IL-4、IL-5、IL-13等细胞因子,增强嗜酸性粒细胞炎症反应。释放的毒性物质直接损伤气道上皮,促进黏液过度分泌,堵塞气道,造成气道高反应性,并参与气道重塑(如平滑肌增生、基底膜增厚),使气道结构发生不可逆改变,导致持续性气流受限。
中性粒细胞性哮喘[6]:以中性粒细胞为主要效应细胞,是Th2-low型哮喘的重要表型,常见于重症哮喘、吸烟相关哮喘及感染诱发的哮喘。其发病机制主要涉及Th1和Th17淋巴细胞以及M1型巨噬细胞的活化。这些免疫细胞分泌并募集相关的促炎因子(如IFN-γ, IL-17, IL-1β, IL-6, IL-8),进而驱动中性粒细胞性炎症反应。活化的中性粒细胞释放弹性蛋白酶、基质金属蛋白酶和活性氧等介质,导致组织损伤、粘液高分泌,并可能参与激素抵抗性和气道重塑的形成。

Figure 1. Overview of the major features of asthma
02 哮喘动物模型建立机制
哮喘动物模型介绍:
动物模型是研究哮喘病理机制和评估新疗法的不可或缺的工具。为了在受控的实验室环境下深入探究这些过程,研究人员开发了多种哮喘动物模型,其中以小鼠模型最为常见,理想的哮喘模型应能可靠地模拟人类哮喘的关键特征。自20世纪中期以来,采用卵清蛋白(OVA)联合佐剂(如氢氧化铝、脂多糖)进行腹腔致敏和气道激发的方案,能成功地在小鼠上复制出人类哮喘的核心表型,已成为哮喘研究领域的“金标准”模型[7]。
OVA模型建立的核心原理:
OVA模型通常采用“系统致敏-局部激发”的两阶段策略:
致敏阶段:通过腹腔或皮下注射OVA抗原,并辅以氢氧化铝等佐剂,强烈诱导Th2型免疫反应,促进抗原呈递细胞活化,并驱动初始T细胞向Th2细胞分化。让免疫系统初次接触OVA并形成“记忆”,产生特异性IgE抗体[8]。
激发阶段:在致敏后的特定时间点(通常为7-14天后),通过鼻腔滴注或雾化吸入的方式使动物气道反复暴露于OVA溶液。局部抗原的再次暴露会触发已致敏的免疫系统,引起强烈的气道局部炎症反应[9]。
阶段 | 主要事件 |
致敏期 | OVA+佐剂注射→APCs提呈→Th2细胞极化→B细胞产生IgE→IgE结合肥大细胞 |
激发期 | 再次接触OVA→OVA交联肥大细胞上的IgE→肥大细胞脱颗粒→释放炎症介质 |
OVA模型建立的主要优势:
- OVA是一种纯化的、无生物活性的蛋白质,其成分明确、来源稳定、批次间差异小。具有高度可重复性及可靠性。且操作简便,有良好的可定制性与灵活性。
- 人类过敏性哮喘主要由Th2型免疫反应驱动。OVA联合氢氧化铝佐剂的方案能高效和特异地诱导强烈的嗜酸性粒细胞炎症和Th2细胞因子反应(嗜酸性粒细胞哮喘)。在OVA致敏基础上,联合以脂多糖可进一步激活Th17细胞,产生IL-17以招募中性粒细胞的关键细胞因子,将中性粒细胞从血液中招募到肺部,形成以中性粒细胞为主导炎症表型。
03 派思维新哮喘动物模型研究
OVA诱导的小鼠哮喘模型:
方法:
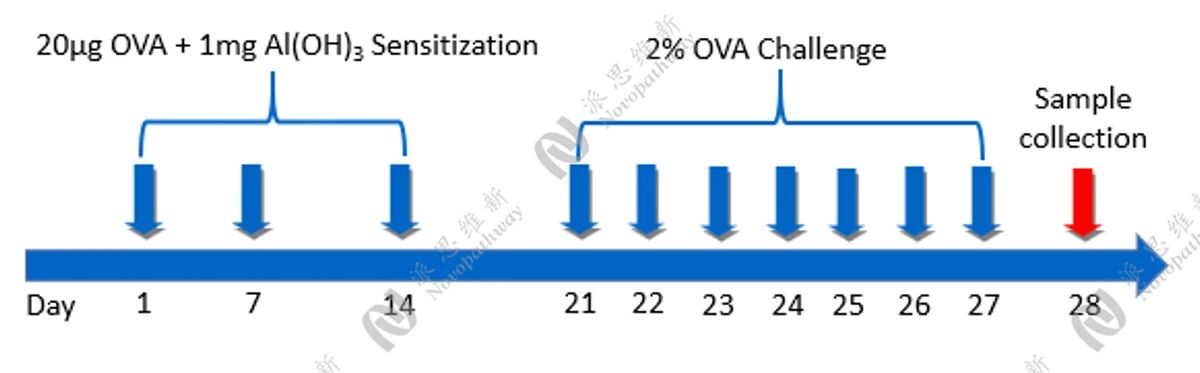
病理HE染色:
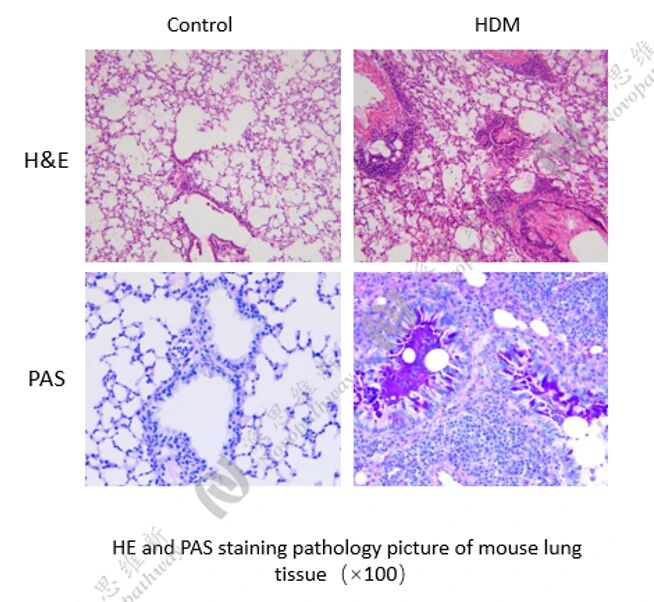
相关指标检测:
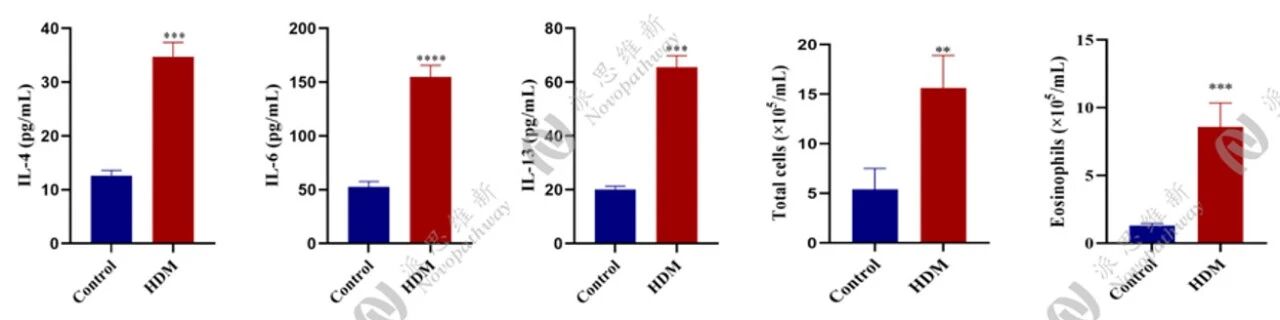
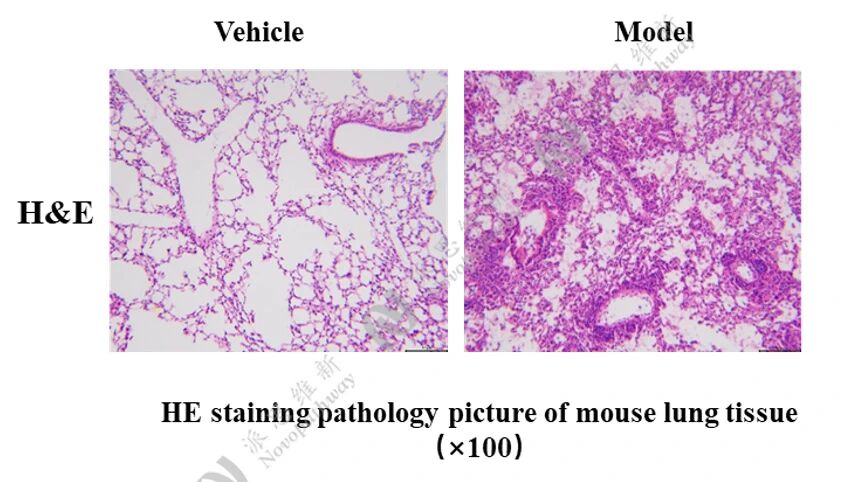
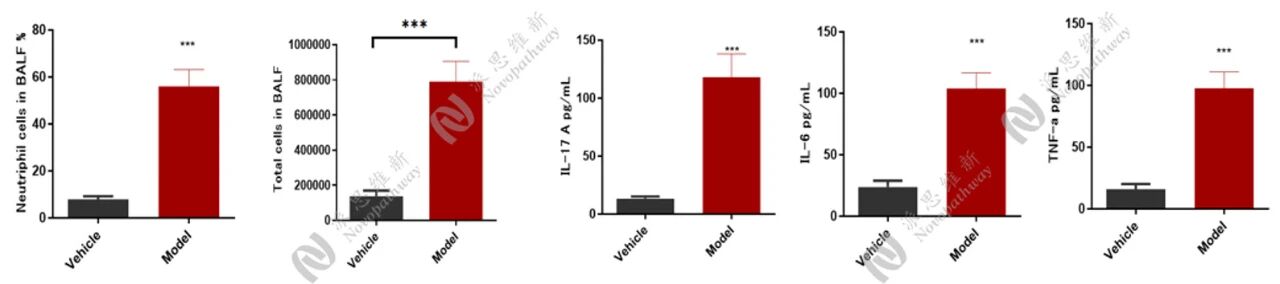
中性粒细胞性小鼠哮喘模型:
方法:
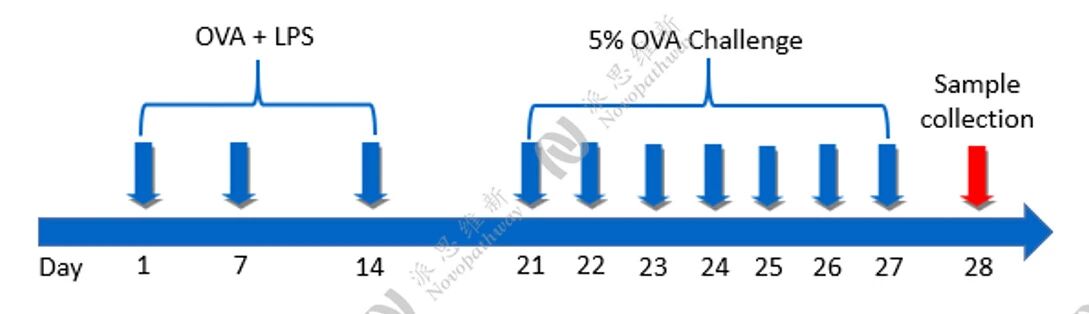
病理HE染色:
相关指标检测:
[1]. Stern J, Pier J, Litonjua AA. Asthma epidemiology and risk factors. Semin Immunopathol. 2020 Feb;42(1):5-15. doi: 10.1007/s00281-020-00785-1.
[2]. Papi A, Brightling C, Pedersen SE, Reddel HK. Asthma. Lancet. 2018 Feb 24;391(10122):783-800. doi: 10.1016/S0140-6736(17)33311-1.
[3]. Dharmage SC, Perret JL, Custovic A. Epidemiology of Asthma in Children and Adults. Front Pediatr. 2019 Jun 18;7:246. doi: 10.3389/fped.2019.00246.
[4]. Wan R, Srikaram P, Guntupalli V, Hu C, Chen Q, Gao P. Cellular senescence in asthma: from pathogenesis to therapeutic challenges. EBioMedicine. 2023 Aug;94:104717. doi: 10.1016/j.ebiom.2023.104717.
[5]. Van Hulst G, Batugedara HM, Jorssen J, Louis R, Bureau F, Desmet CJ. Eosinophil diversity in asthma. Biochem Pharmacol. 2020 Sep;179:113963. doi: 10.1016/j.bcp.2020.113963.
[6]. Yamasaki A, Okazaki R, Harada T. Neutrophils and Asthma. Diagnostics (Basel). 2022 May 8;12(5):1175. doi: 10.3390/diagnostics12051175.
[7]. Bates JH, Rincon M, Irvin CG. Animal models of asthma. Am J Physiol Lung Cell Mol Physiol. 2009 Sep;297(3):L401-10. doi: 10.1152/ajplung.00027.2009.
[8]. Eisenbarth SC, Colegio OR, O'Connor W, Sutterwala FS, Flavell RA. Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminium adjuvants. Nature. 2008 Jun 19;453(7198):1122-6. doi: 10.1038/nature06939.
[9]. Zosky GR, Sly PD. Animal models of asthma. Clin Exp Allergy. 2007 Jul;37(7):973-88. doi: 10.1111/j.1365-2222.2007.02740.x.



上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




