- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

放射性疾病动物模型研究的整体解决方案
前言
放射性疾病是人体受到一定剂量的电离辐射照射以后,引起的机体组织器官损害以及功能障碍的一种疾病,可分为四大类:电离辐射所致的全身性疾病,有外照射急性放射病、外照射亚急性放射病、外照射慢性放射病内照射放射病。电离辐射所致的器官组织的损伤,包括急性放射性皮肤损伤、慢性放射性皮肤损伤、放射性甲状腺炎、放射性甲状腺功能减退症、放射性甲状腺良性结节、放射性白内障、放射性肺炎及放射性肺纤维化、放射性骨损伤、放射性性腺损伤、放射性口腔炎、放射性直肠炎、放射性膀胱炎以及其他受照射器官和组织损伤;电离辐射诱发的恶性肿瘤,比如白血病、甲状腺癌、骨肿瘤、肺癌、皮肤癌等等;放射性复合损伤,包括放烧复合伤和放冲复合伤。
01 放射性肺损伤
放射性肺损伤(Radiation-induced lung injury, RILI)是胸部恶性肿瘤(肺癌、食管癌、乳腺癌、纵膈内恶性肿瘤)在接受放射性治疗过程中正常肺组织不可避免的受到一定剂量的射线照射而造成的肺损伤[1]。放射性肺损伤作为临床上常见的放疗并发症,影响着肿瘤靶区剂量以及全局放疗的疗效,是放疗疗效最大程度发挥的主要制约因素。
放射性肺损伤分为早期的急性放射性肺炎和晚期的慢性放射性肺纤维化,早期组织损伤表现为,上皮或内皮细胞释放炎症介质促进凝血并使 ECM 短暂增加,同时促进血管扩张和通透性增加。招募炎症细胞到达损伤部位,随后炎症细胞可分泌多种细胞因子,增强炎症反应并促进纤维细胞增殖。肺纤维化是晚期的损伤改变,其病理改变主要表现为上皮细胞受损、肺部细胞外基质的积聚增加和胶原纤维增生等,持续发展可导致肺组织结构破坏,肺换气功能受损,呼吸衰竭,严重威胁人类的生命健康[2, 3]。纤维化通常被认为是一种损伤后修复失控的伤口愈合反应。因此在肺损伤修复过程中,有四个不同的阶段,包括(1)凝血阶段;(2)炎症阶段;(3)成纤维细胞迁移和增殖阶段;(4)恢复正常组织结构的重塑阶段[4]。
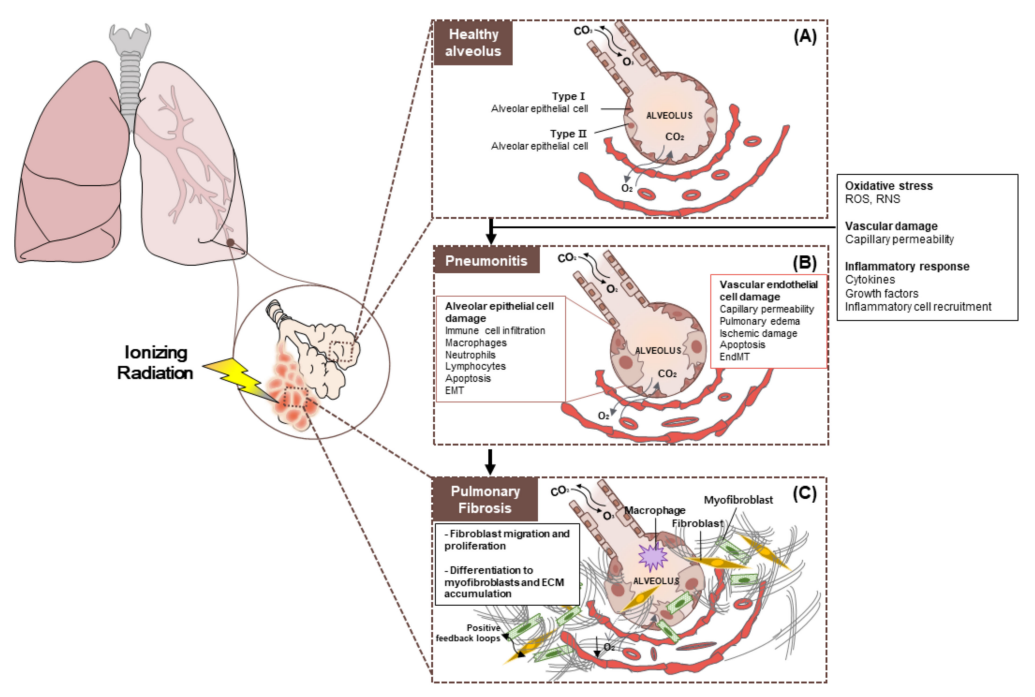
辐射所致肺损伤[5] (A) 健康肺泡;(B) 放射性肺炎;(B) 放射性肺纤维化(DOI: 10.3390/cancers12061561)
到目前为止,临床实际治疗中还没有对放射性肺损伤很有效的手段。现有的药物防治研究重点大都致力于清除经过放射而产生的自由基以尽力促进Ⅱ型肺泡细胞分裂以及抑制肺泡TGF-β1分泌等方面。放射性肺损伤一般采用大鼠或小鼠制备动物模型,该模型主要用于放射性肺炎及肺纤维化的发病机制,以及相关防治药物的研究。制备动物模型的放射源采用用于临床放射治疗的 X线直线加速器或60Co 治疗机。依据研究目的不同,模型制备方式如全胸或半胸照射、单次或分割照射及照射剂量各异。C57BL/6因对射线敏感且易发生肺纤维化而作为小鼠放射性肺损伤的常规种系。
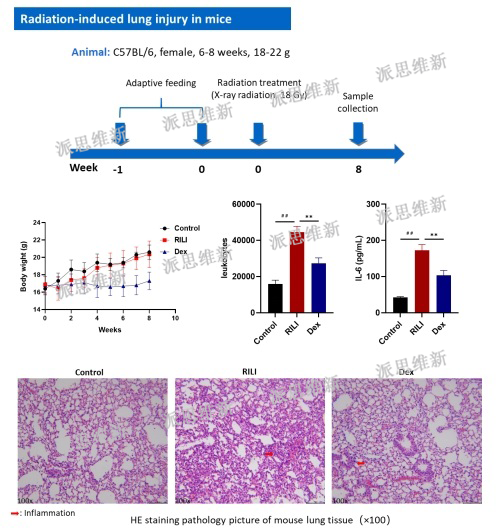
派思维新放射性肺炎模型案例
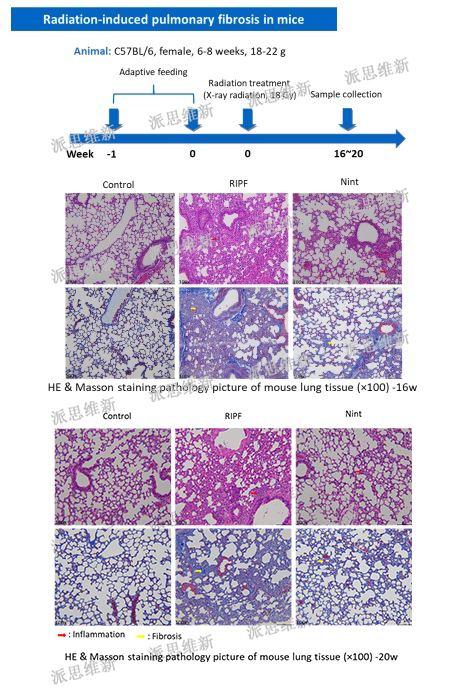
派思维新放射性肺纤维化模型案例
02急性放射性疾病
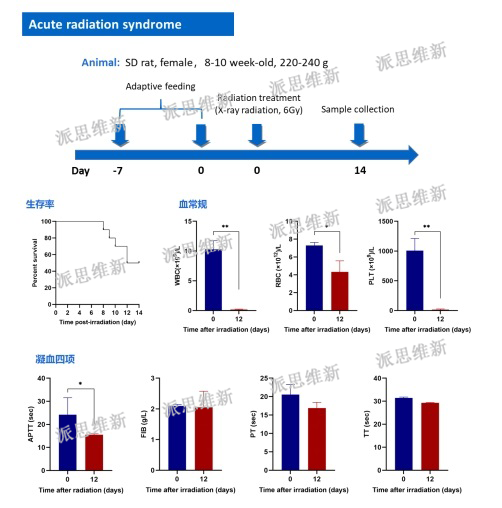
急性放射病(acute radiation sickness,ARS)是人体一次或短时间(数日)内受到大剂量辐射照射时引起的全身性疾病,通常的致病原因包括:医疗照射、事故与应急照射、核武器照射。当受到大于1 Gy 的均匀或比较均匀的全身照射即可引起ARS,损伤的程度与辐射剂量呈正相关,一般分为骨髓型、肠型和脑型。在辐射事故中,以骨髓型 ARS多见,其以骨髓造血组织损伤为基础病变,主要临床表现包括白细胞减少、感染和出血等。
通常一个治疗用或预防用药物上市之前,需要在适用人群中开展人体临床试验获得足够的有效性和安全性数据,以证明该产品的治疗获益,并尽可能全面地暴露该产品的治疗风险。而在研发用于治疗或预防某些重大传染性疾病,和暴露于某种有害物质后产生的病症的产品时,人体临床试验存在伦理问题或者不具有操作性。为了解决这个问题,FDA 于 2002年发布了动物法则并于2015 年 10 月对其进行了修订。截至目前,基于动物法则获得 FDA 批准的产品中包括 4 个用于治疗ARS的产品:Neupogen、Neulasta、Leukine 和 Nplate[6-11]。
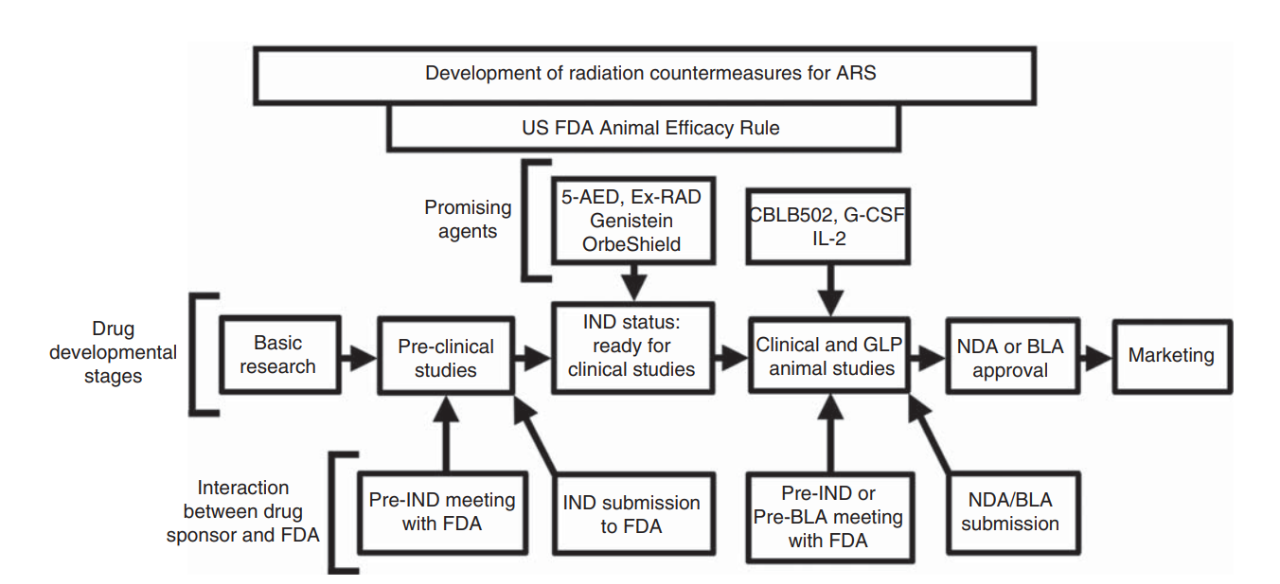
基于FDA动物法则开发药物的不同阶段[12]
根据当前研究进展,小鼠被认为是小动物中最适合用于评价辐射防护剂或辐射缓解剂有效性的试验动物,而选择小鼠模型进行研究时,应至少包2个小鼠品系;犬和非人灵长类动物被认为是用于评价骨髓型ARS治疗药物有效性时较为合适的大动物模型。最常用的小鼠品系有C57BL/6、C3H/HeN、B6D2F1/J 和BALB /c,而最常用的犬类动物品系和非人灵长类动物则分别是比格犬和恒河猴。根据动物法则的要求,动物研究终点应与临床获益明确相关,因此,通常选择 30 d 存活率(啮齿类动物)或 60 d 存活率(犬和非人灵长类动物)作为骨髓型ARS治疗药物有效性试验的主要药效终点,而将试验动物的血液学参数,尤其是绝对中性粒细胞(absolute neutrophil count,ANC)的数量,可作为次要终点,对次要终点的分析有助于对疾病或病症的了解和对治疗效果的描述。
派思维新急性全身放射性疾病动物模型案例
03 放射性肠炎
放射性肠炎(radiation enteritis,RE)亦称放射性肠病、放射性黏膜炎、盆腔放射病,放射性肠炎是指盆腔、腹腔以及胸腔后恶性肿瘤患者经过放射治疗后导致的肠道炎症性反应疾病,是放疗患者中常见的并发症类型之一,可累及小肠和结直肠,并表现出多种消化道症状和体征,如排便习惯改变、腹泻、消化道出血、肠梗阻、肠瘘、贫血、营养不良等。在恶性肿瘤患者中放射性肠炎的发生率约为5%~17%,且发生人数随着恶性肿瘤的发生率逐年增长不断增多。
临床上依据其病理学特点和临床表现等将在放射治疗期间及放射治疗后3-6 个月内发生者定义为急性期(或称为急性放射性肠炎),如果持续或发生时间大于3-6 个月则称为慢性期(或称为慢性放射性肠炎)。急性放射性肠炎的主要病理学特征为快速增殖的隐窝细胞死亡和固有层中的急性炎症反应并可见上皮细胞凋亡、隐窝脓肿等[13]。慢性放射性肠炎病理学改变包括粘膜萎缩、血管炎、小血管缺血、肠壁增厚等,其中黏膜下层纤维化和微血管硬化、闭塞为最具特征性的表现[14]。
放射性肠炎发病机制复杂,涉及细胞凋亡、微血管损伤、炎症介质表达上调、免疫屏障破坏及肠道菌群失调等多个方面[15,16]。总体上可理解为电离辐射作用于组织细胞后导致体内的 DNA 等大分子电离激发,发生化学键断裂等多种形式的损伤,继而诱导细胞凋亡、变性、坏死、功能障碍等生物学效应。其中微血管损伤是放射性肠炎的重要发病机制之一,主要表现为微血管结构破坏、数目减少密度下降、微血管硬化、新生血管异常生长等。
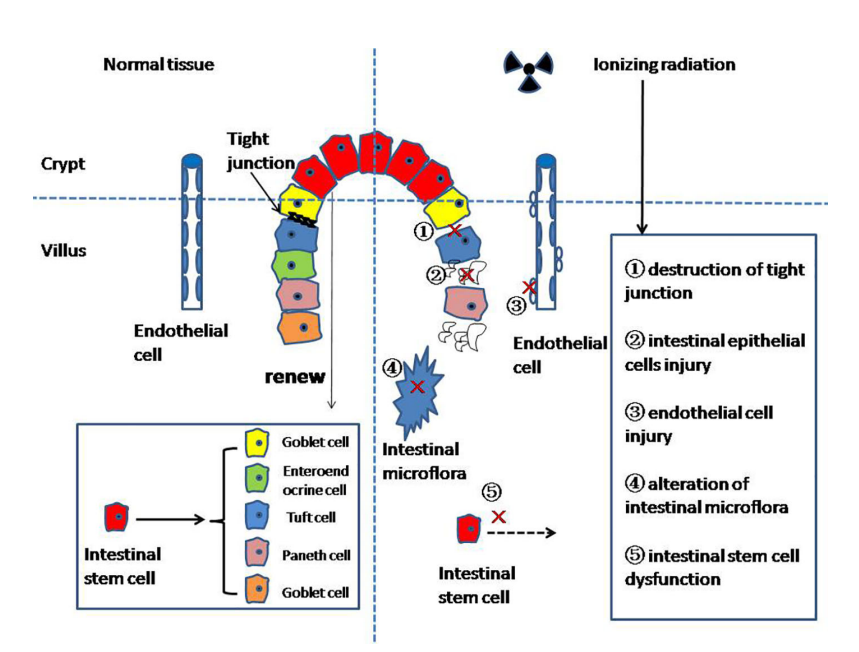
派思维新放射性肠炎模型案例

04 放射性皮肤损伤
急性放射性皮肤损伤(RSI)常发生于核事故和肿瘤放射治疗中。放射治疗所致的皮肤损伤多为亚急性,以 Ⅰ~Ⅱ 度放射性皮肤损伤常见,Ⅲ 度及以上放射性皮肤损伤多由事故性照射引起。在肿瘤放疗中,RSIs的发生率也逐渐升高,近 85% 的肿瘤患者因放疗而出现不同程度的皮肤损伤[18]。研究发现,约 95% 的患者在接受放疗或放疗后都会出现皮肤红肿,甚至溃疡,且常伴有脱发脱屑,这说明放射性皮肤损伤是最为常见放射治疗并发症之一。与普通烧伤和溃疡不同,辐射直接损害皮肤及其深层组织细胞,导致受辐射区域干燥、失去弹性、色素沉着、软组织纤维化、毛细血管扩张和放射性皮炎[19]。急性放射性皮肤损伤患者临床主要表现为局部皮肤瘙痒,会发生脱皮、疼痛、溃疡造成局部感染;病情严重的患者皮肤会变薄,产生瘢痕、挛缩[20,21],严重影响患者的生活质量。
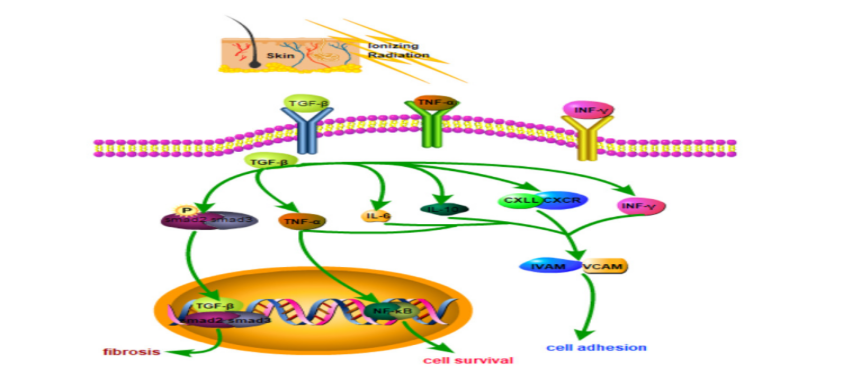
放射性皮肤损伤机制[22]
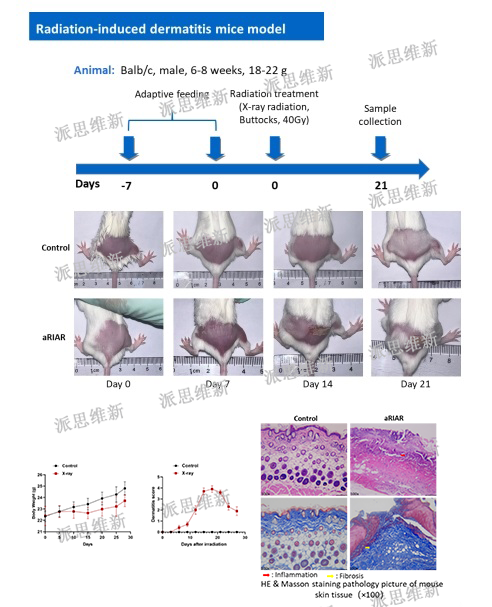
目前现有许多药物和敷料可用于预防和治疗放射性皮肤损伤(例如皮质类固醇、透明质酸、三乙醇胺、硫糖铝乳膏、芦荟、金盏花乳膏以及水基乳膏)。由于缺乏高质量的大样本研究和统一的评估标准,各种研究的结论往往相互矛盾,缺乏普遍性。临床上,RSI的预防和管理通常基于个人经验,而没有科学证据。为探究辐射性皮肤损伤的核心机制,开发更具成本效益、副作用更小的保护措施,以有效保护患者的利益,确保化疗顺利进行,并提高患者的生活质量,放射性皮肤损伤动物模型构建是第一步,也是重要一步。
派思维新放射性皮炎模型案例
参考文献
[1] JENKINS P, WELSH A. Computed tomography appearance of early radiation injury to the lung: Correlation with clinical and dosimetric factors [J]. Int J Radiat Oncol Biol Phys, 2011, 81(1): 97.
[2] Chargari C, Riet F, Mazevet M, et al. Complications of thoracic radiotherapy[J]. La Presse Médicale, 2013,42(9): e342-e351.
[3] Lierova A, Jelicova M, Nemcova M, et al. Cytokines and radiation-induced pulmonary injuries[J]. Journal of Radiation Research, 2018,59(6):709-753.
[4] Wynn T A. Integrating mechanisms of pulmonary fibrosis[J]. The Journal of Experimental Medicine, 2011,208(7):1339-1350.
[5] Jin H, Yoo Y, Kim Y, Kim Y, Cho J, Lee YS. Radiation-Induced Lung Fibrosis: Preclinical Animal Models and Therapeutic Strategies. Cancers (Basel). 2020 Jun 12;12(6):1561.
[6] FDA. Biologic license application: 125031. NEULASTA. 2015. Label ( PDF) [EB/OL]. Silver Spring: FDA. 2015-11-13[2021-02-22]. https://www. accessdata. fda. gov /drugsatfda_ docs/label /2015 /125031s180lbl. pdf.
[7] FDA. Biologic license application: 103353. NEUPOGEN. 2015. Label (PDF) [EB/OL]. Silver Spring: FDA. 2015- 03-30[2021-02-22[. https://www. accessdata. fda. Gov/drugsatfda_ docs/label /2016 /103353s5188. pdf.
[8] FDA. Biologic license application: 103362. LEUKINE. 2018. Label ( PDF) [EB/OL]. Silver Spring:
[9] FDA. 2018-03-29[2021-02-22]. https://www. accessdata. fda. gov /drugsatfda_ docs/label /2018 /103362s5240lbl. pdf.
[10] FDA. Biologic license application: 125268. NPLATE. 2021. Lable ( PDF) [EB /OL]. Silver Spring:
[11] FDA. 2021- 01-28[2021-02-22]. https://www. accessdata. fda. gov /drugsatfda _ docs/label /2021 /125268s168lbl. pdf.
[12] Singh VK, Newman VL, Berg AN, MacVittie TJ. Animal models for acute radiation syndrome drug discovery. Expert Opin Drug Discov. 2015 May;10 (5):497-517.
[13] Hauerjensen M, Denham JW, Andreyev HJN. Radiation enteropathy-pathogenesis, treatment and prevention[J]. Nat Rev Gastroenterol Hepatol, 2014,11(10):470-479.
[14] Theis VS, Sripadam R, Ramani V, et al. Chronic radiation enteritis[J]. Clin Oncol (R Coll Radiol), 2010,22(1):70-83
[15] KUMAGAI T, RAHMAN F, SMITH A M. The microbiome and radiation induced-bowel injury: evidence for potential mechanistic role in disease pathogenesis [J]. Nutrients,2018,10( 10) : 1405.
[16] HARB A H, ABOUT F C, SHARARA A I. Radiation enteritis [J]. Current Gastroenterology Reports, 2014, 16( 5) : 1-9.
[17] Fan J, Lin B, Fan M, et al. Research progress on the mechanism of radiation enteritis. Front Oncol. 2022;12:888962. Published 2022 Sep 5. doi:10.3389/fonc.2022.888962.
[18] Salvo N, Barnes E, van Draanen J, et al. Prophylaxis and management of acute radiation-induced skin reactions: a systematic review of the literature. Curr Oncol. 2010;17(4):94-112. doi:10.3747/co.v17i4.493.
[19] Singh M, Alavi A, Wong R, Akita S. Radiodermatitis: A Review of Our Current Understanding. Am J Clin Dermatol. 2016;17(3):277-292. doi:10.1007/s40257-016-0186-4.
[20] KumarSoniS, Basu M, AgrawalP, etal. Evaluation of gammar adiation induced biochemical changes skin for dose assesment: a study on small experimental animals [J]. Disaster Med Public Health Prep, 2019, 13 (2): 197- 202.
[21] AdamsT G, YeddanapudiN, Clay M, etal. Modeling cutaneous radiation injure from fallout [J]. Disaster Med Public Health Prep, 2019,13 (3): 463-469
[22] Yang X, Ren H, Guo X, Hu C, Fu J. Radiation-induced skin injury: pathogenesis, treatment, and management. Aging (Albany NY). 2020;12(22):23379-23393. doi:10.18632/aging.103932.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




