- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

雄激素性脱发(AGA)动物模型—从机制研究到药效评价的全方案
01 前言
雄激素性脱发(Androgenetic Alopecia, AGA)又称雄秃,是最常见的脱发类型,它是起始于青春期或青春后期的一种进行性毛囊微型化的疾病,困扰着全球数以亿计的人群。在中国,男性患病率高达21.3%,女性患病率约为6.0%,而70岁及以上人群中男女患病率分别为41.4%和11.8%,且这一数字仍在持续增长。虽然此疾病对人们的身体健康影响不大,但却严重影响患者的心理健康和生活质量。
AGA的发病机制主要与雄激素代谢异常、毛囊微小化及毛囊周期紊乱有关。面对如此普遍的疾病,开发有效治疗方法迫在眉睫,而动物模型作为连接基础研究与临床应用的桥梁,已成为探索AGA发病机制和评价新疗法的关键平台。本文将系统介绍AGA动物模型的构建方法、应用场景及药效评价体系,为科研与药物开发提供实验方案参考。
02.机制解码,雄激素脱发的核心通路
雄激素性脱发的病理机制错综复杂,其核心在于雄激素信号通路的异常激活。睾酮在5α-还原酶作用下转化为活性更强的二氢睾酮(DHT),后者与毛囊真皮乳头细胞中的雄激素受体(AR)结合,引发一系列级联反应。 DHT对AR的亲和力比睾酮高出2-3倍,激活效力增强3倍。这种过度的结合导致毛囊周期紊乱和微小化,终毛逐渐被毳毛替代,最终形成特征性的脱发模式。
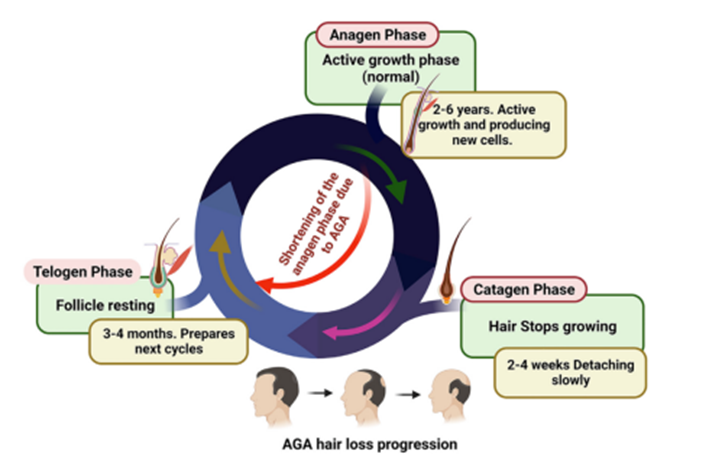
在分子层面,多条信号通路共同参与了这一过程:Wnt/β-catenin通路:雄激素抑制此通路活性,干扰毛囊正常再生[1];炎症反应通路:毛囊周围炎症浸润,TNF-α、IL-1β等炎症因子加速毛囊退化;转化生长因子-β(TGF-β)通路:促进毛囊细胞凋亡的关键因子。
03.模型构建,五大技术路径的突破与挑战
可靠的AGA动物模型是机制研究与药物开发的核心工具,但需根据研究目标合理选择模型类型和评价体系。动物模型需模拟人类AGA的激素依赖、毛囊周期异常及组织病理特征,目前科研界已开发出五大技术路径,各有千秋:
2.1激素诱导模型:黄金标准
通过给动物注射雄激素(如DHT或睾酮)来诱导脱发。这种方法可以模拟雄激素过多引起的脱发病理生理状态,操作简单,成本低,是目前最广泛应用的方法。传统方法采用多点皮下注射,但存在操作困难、溶剂积聚导致皮肤溃烂等问题。脱毛技术也经历了革新,“剃毛+脱毛膏”组合已取代刺激性的松香石蜡拔毛法,减少对毛囊周期的干扰,延长观察窗口期至18天[3]。
2.2基因工程模型:精准模拟
包括AR转基因小鼠和基因敲除模型。K5-HAR转基因小鼠通过角蛋白启动子(如K14)驱动AR在毛囊中过表达,模拟人类AGA的毛囊敏感状态,用于研究AR信号通路的特异性作用。虽能在表皮表达人AR,但无法精准定位在毛囊真皮乳头细胞,与人类AGA存在差距[4]。新兴的CRISPR/Cas9技术,使动物缺失特定的基因或基因功能,从而产生与雄激素源性脱发相关的表型,有望构建更精准的基因修饰模型。
2.3自发性模型:稀缺资源
残尾猕猴是唯一自发出现AGA的动物,可用于转化医学研究。但因成本高昂,饲养周期长且难以获得,应用受限[5]。
2.4异种移植模型:人鼠嵌合
将人秃顶头皮移植至裸鼠,保留原始毛囊特性,是评价人源细胞治疗的理想平台。但技术要求高,成功率波动大。
2.5药物诱导模型:快速但非特异
使用某些化学物质(如化学剂Minoxidil等)或化学诱导剂,如硫酸可的松(corticosteroid)来诱导脱发。这些物质可以干扰毛发生长周期,抑制毛囊干细胞活性,导致毛发稀疏。模拟脱发的病理过程,但病理机制与人类AGA差异较大,应用逐渐减少。
派思维新实验模型展示:
1.Testosterone induced AGA model in mice
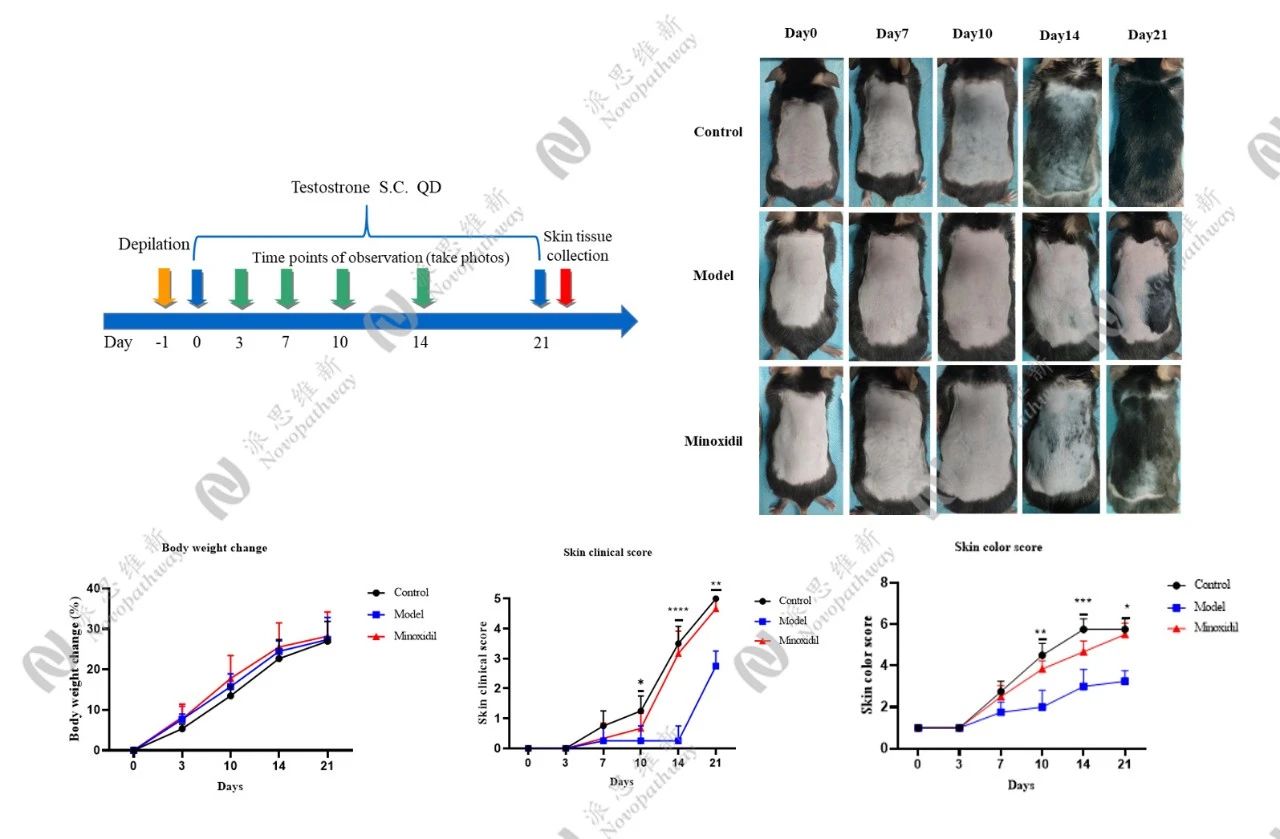
2.DHT induced AGA model in mice
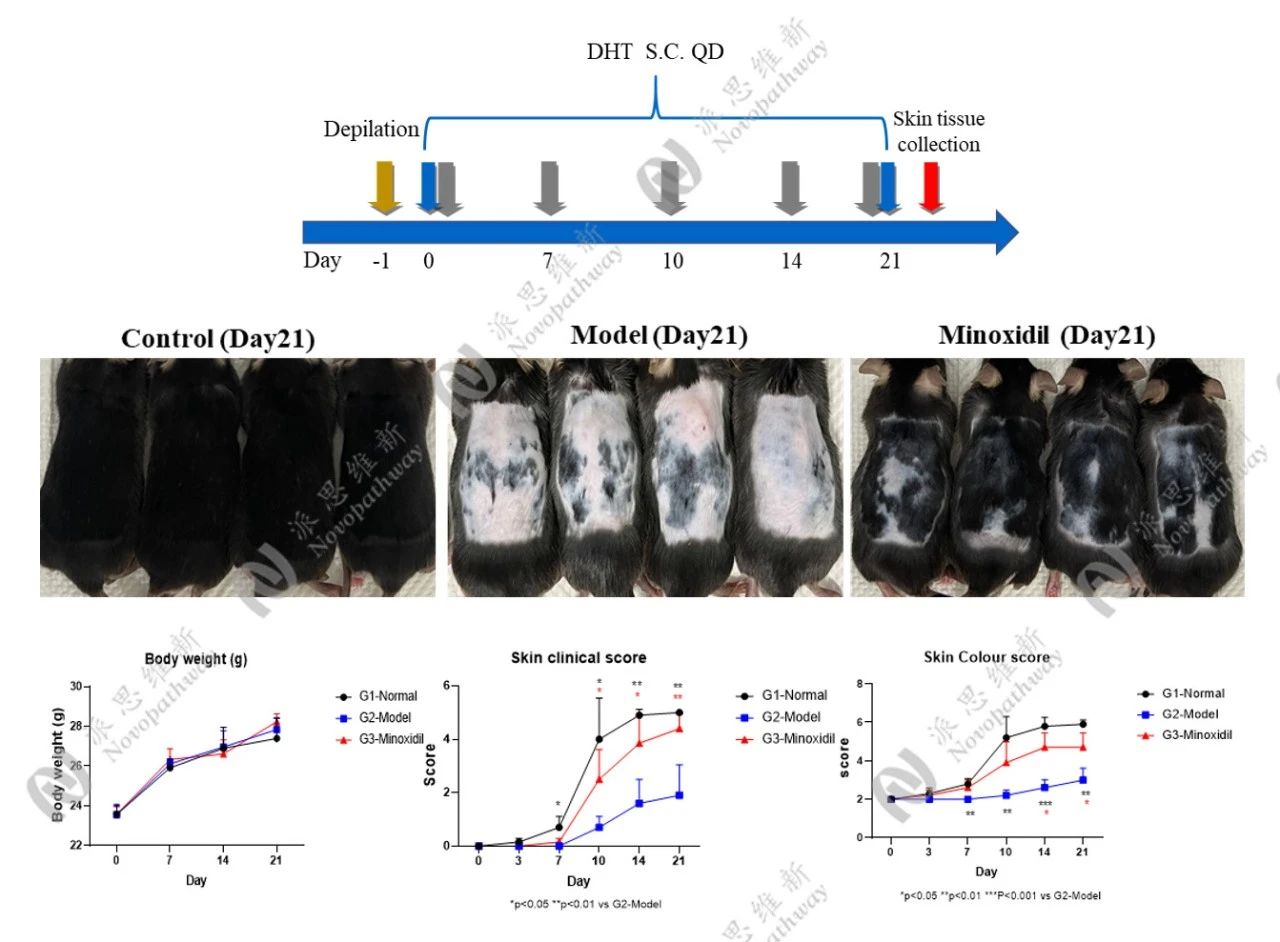
04.评价体系,多维度精准评估药效
建立客观、量化的评价体系是AGA模型价值实现的关键。现代研究采用多维度指标综合评价毛发再生效果:
3.1宏观评分系统
3.1.1毛发密度:
背皮评分法,单位面积内毛发的数量及分布情况,反映毛发生长总体状态。此法对毛发再生过程精细划分:
-灰色区域期(2.0-3.0分):毛囊激活初期;
-黑色区域期(3.0-4.0分):毛发形成但未突破表皮;
-毛发穿出期(4.0-5.0分):毛发萌出长度≤2mm ;
-毛发覆盖期(5.0-6.0分):毛发长度>2mm,完全覆盖;
该系统要求至少3人盲法评估或借助图像分析软件,最大限度减少主观偏差。
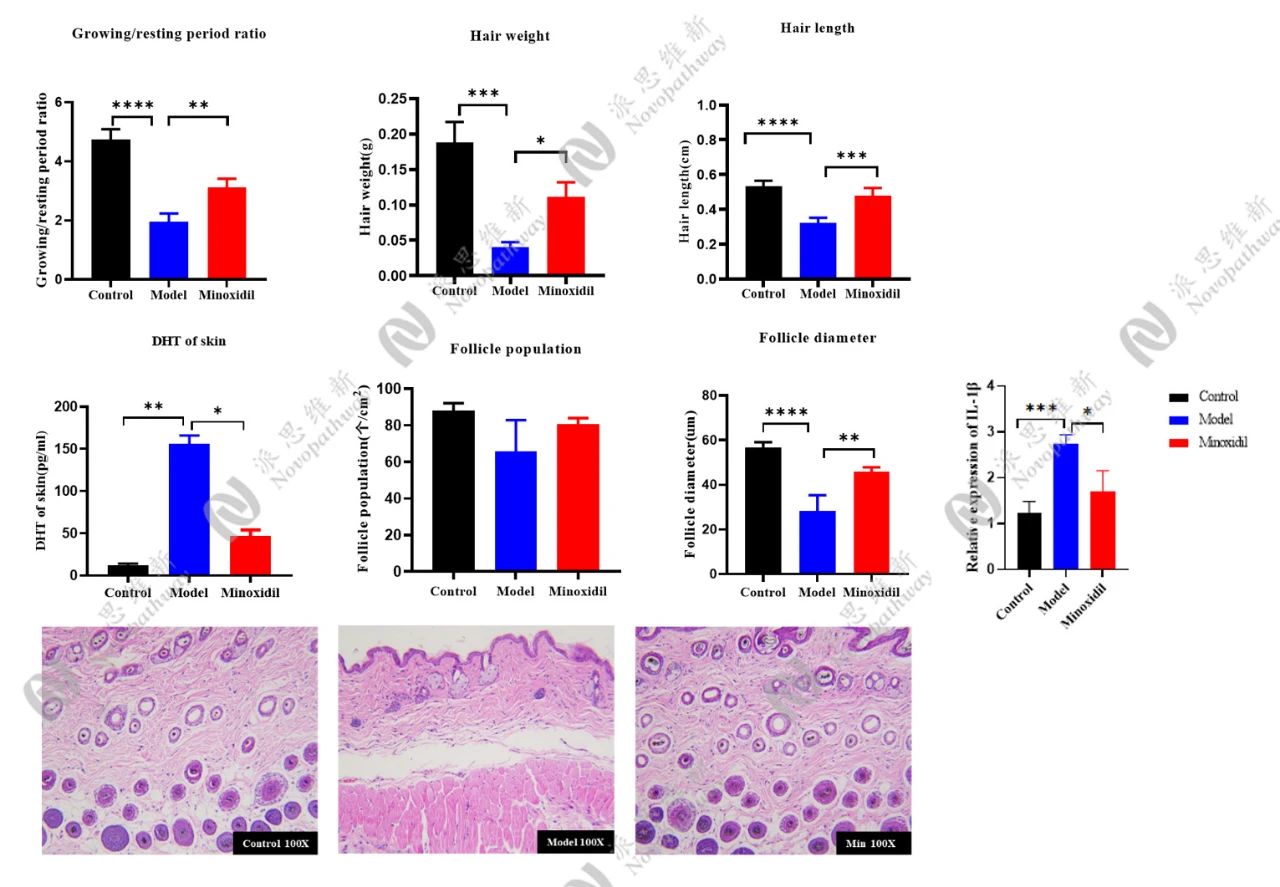
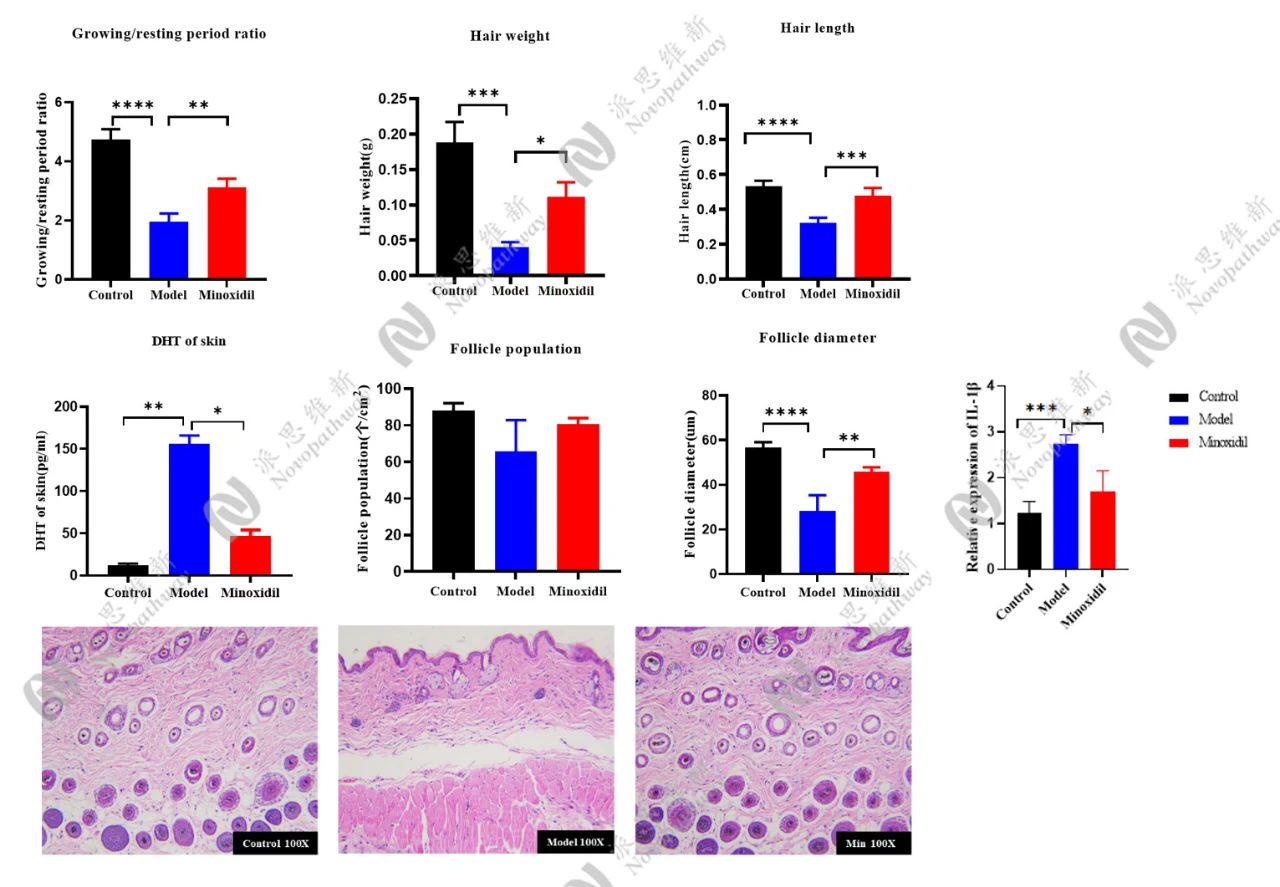
3.1.2毛发生长周期(Anagen/Telogen比例):
毛囊处于生长期(Anagen)或休止期(Telogen)的比例,直接反映毛囊活性。检测原理为小鼠毛发周期具有同步性,剃毛后可诱导毛囊进入生长期,并且在AGA模型中,DHT或基因缺陷会导致生长期缩短、休止期延长。
检测方法:
肉眼观察皮肤颜色:生长期:皮肤呈粉红色(毛囊充血增殖);休止期:皮肤苍白(毛囊萎缩)。
毛发拔出试验(Hair Pluck Test):轻拔毛发,生长期毛发带有毛根鞘(白色鞘状结构),休止期毛发无鞘且易脱落。统计拔出的生长期毛发占比(需至少重复3次)。
荧光染料标记:注射荧光染料(如Hoechst 33342)标记增殖期毛囊细胞,通过荧光显微镜定量活性毛囊。
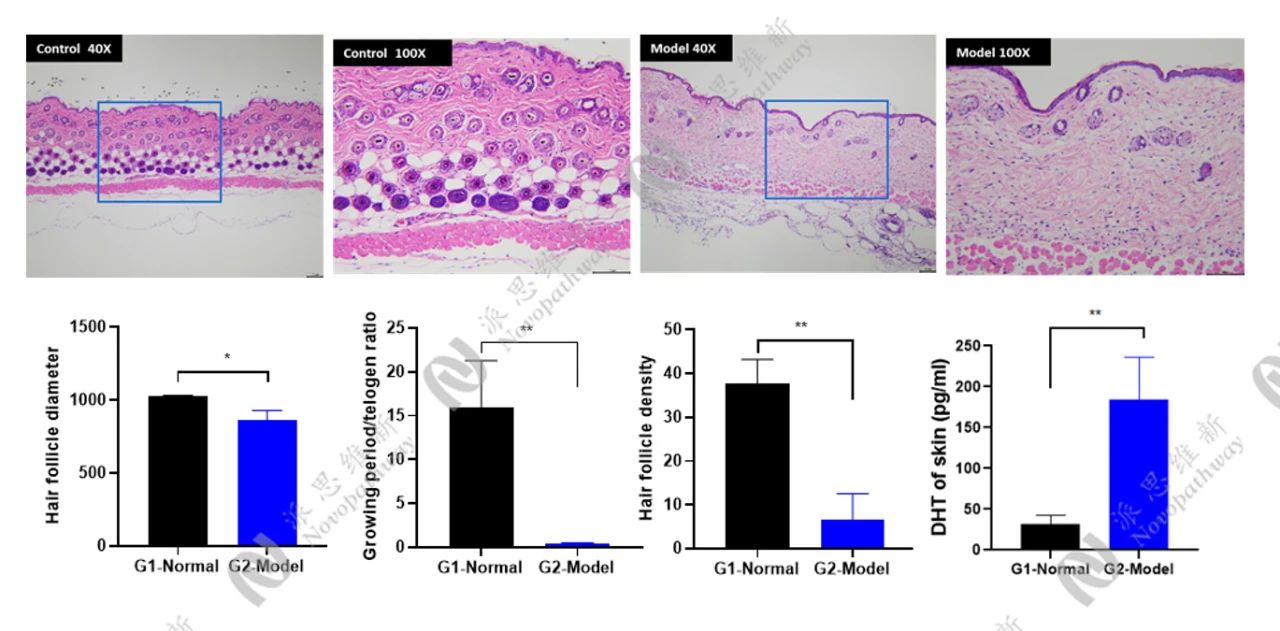
3.2组织病理学分析
毛囊微小化:HE染色是金标准,准确测量毛囊数量、直径及生长期/退行期比例。Masson三色染色则能评估毛囊周围纤维化程度,这是AGA晚期的特征性改变。
炎症浸润:CD3+ T细胞、巨噬细胞标记(免疫组化)。
3.3分子标志物检测
-激素水平:检测皮肤局部T、DHT浓度;
-酶活性分析:5α-还原酶(SRD5A2)活性检测;
-炎症因子谱:TNF-α、IL-1β等表达量;
-信号通路分子:AR、β-catenin、TGF-β1等关键蛋白表达;
05.药效验证,从模型到临床的转化之路
AGA动物模型已成为新药研发不可或缺的平台,近年来取得多项突破性进展:
4.1传统药物优化
植物药已被应用于AGA治疗多年。在实验研究中,植物提取物的局部和皮下给药已被扩展,显示出良好的毛发促进作用[6]。锯齿叶-黄芩提取物的网络药理学研究与动物实验验证显示,其通过多靶点调控发挥疗效:降低皮肤DHT含量31.7%,提升血管内皮生长因子(VEGF)45.2%,同时调节AR、CYP19A1等26个靶点表达。
4.2生物技术突破
PROTAC技术引领新一代疗法:浙江大学团队开发的非侵入性AR降解剂C6实现重大突破,其皮肤滞留率达1.41%,能降解纳摩尔级AR蛋白(DC 50=262.38 nM),在0.4%浓度下使C57 BL/6小鼠毛发几乎完全再生,效果媲美5%米诺地尔[7]。
干细胞疗法崭露头角:脐带间充质干细胞条件培养基(CM)联合口服抗雄激素治疗显示协同效应。CM中的旁分泌因子通过下调炎症基因、上调毛发诱导基因,促进毛囊提前进入生长期[8]。
4.3新型生物材料
重组胶原蛋白疗法表现亮眼:局部注射2.0mg/mL的XVII型人源化胶原蛋白显著促进AGA小鼠毛发生长,其机制与激活Wnt信号通路相关。而与III型胶原蛋白联用时,效果进一步增强,为毛囊干细胞提供稳定的微环境。
06.未来之路,模型优化与多组学整合
面对现存挑战,AGA动物模型的发展呈现三大趋势:
5.1模型优化方向
人源化转基因模型的精准度提升,特别是实现AR在毛囊真皮乳头细胞的靶向表达,将极大提高临床预测价值。
5.2评价体系升级
人工智能驱动分析系统正在取代人工评分。自动毛发计数算法结合高分辨率成像,使毛囊密度评估更精准。多模态评价整合宏观、微观及分子多层次数据,构建全面药效图谱。
5.3转化医学突破
类器官技术与动物模型互补:将AGA患者来源的毛囊祖细胞形成3D类器官,实现“个体化药筛”。多组学整合分析(转录组+蛋白组+代谢组)揭示药物作用的全局网络,加速靶点发现。
07.总结
随着2023年《中国雄激素性脱发临床诊疗指南》的更新,动物模型数据的临床转化路径日益清晰,为从实验室到临床的最后一公里铺平道路。浙江大学生命科学学院的最新突破彰显了这一领域的巨大潜力:他们开发的非侵入性AR降解剂C6在动物实验中实现了毛发几乎完全再生,药效媲美传统药物米诺地尔。这一进展仅仅是开始。随着基因编辑技术的精进和人源化动物模型的发展,科研人员正在构建更贴近人类脱发病理的实验平台。当重组胶原蛋白、干细胞疗法和新型靶向药物在这些活体实验室中不断优化,毛囊再生的奥秘终将被完全破解。
撰稿人:吴金苗
参考文献:
[1] KISHIMOTO J, BURGESON R E, MORGAN B A. Wnt signaling maintains the hair-inducing activity of the dermal papilla [J]. Genes Dev, 2000, 14(10): 1181-1185.
[2] HIROYUKI M, YASUAKI M, NGUYEN T B, et al.Hair follicle aging is driven bytransepidermal elimination of stem cells via COL17A1 proteolysis[J]. Science,2016,351(6273):559-613.
[3] RANDALL V A. Hormonal regulation of hair follicles exhibits a biological paradox [J]. Semin Cell Dev Biol, 2007, 18(2): 274-285.
[4] MA L, LIU J, WU T, et al. 'Cyclic alopecia' in Msx2 mutants: defects in hair cycling and hair shaft differentiation [J]. Development, 2003, 130(2): 379-389.
[5] UNO H, KURATA S. Chemical agents and peptides affect hair growth [J]. J Invest Dermatol, 1993, 101(1 Suppl): 143-147.
[6]KAZUYZ M, FUMINK T, KEIICH S,et al. Effects of ginseng rhizome and ginsenoside Ro on testosterone 5α-reductase and hair re-growth in testosterone-treated mice[J].Phytotherapy Research, 2012,26(1):48-53.
[7]XINFEN M, WEITONG H, MINGFEI W, et al. Discovery of a Novel Non-invasive AR PROTAC Degrader for the Topical Treatment of Androgenetic Alopecia[J]. Journal of Medicinal Chemistry, 2024, 67(24):22218-22244.
[8] GARZA L A, YANG C C, ZHAO T, et al. Bald scalp in men with and rogeneticalopecia retains hair follicle stem cells but lacks CD200-rich and CD34-positive hair follicle progenitor cells [J]. J Clin Invest, 2011, 121(2): 613-622.
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




