- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

代谢类疾病 | 如何构造(DIO)肥胖导致的糖尿病动物模型?
01.肥胖与糖尿病的流行病学关联及病理机制
全球范围内,肥胖与糖尿病发病率呈上升趋势,且日益年轻化。有调查显示,43%的18岁及以上成人超重,16%罹患肥胖症;同时,约8%的儿童青少年亦受肥胖困扰。这一趋势与饮食结构失衡、体力活动减少、睡眠不足及生存压力增大密切相关[1][2]。尤为关键的是,肥胖是2型糖尿病(T2DM)发生的重要风险因素,早期肥胖能显著提升其发病风险[3]。
肥胖的本质在于长期能量摄入超过消耗导致的能量失衡,其发生受遗传、环境及心理因素共同调控。肥胖作为多种疾病的病理枢纽,构成了多种重大慢性疾病的共同风险基础,包括心血管疾病、癌症、神经系统疾病、慢性呼吸系统及消化系统疾病。
其中,肥胖与糖尿病的关联尤为密切且具有双向性:肥胖会驱动T2DM发生发展,有研究显示,体重下降5-10%可使T2DM发生率显著降低38%。其核心机制在于,肥胖状态下,脂肪细胞脂质储存过载导致脂肪酸及促炎细胞因子溢出,在肝脏、肌肉等异位组织沉积并诱发慢性低度炎症。异位脂质堆积及炎症因子共同干扰胰岛素信号传导,降低细胞对胰岛素的敏感性,形成胰岛素抵抗,迫使胰岛β细胞代偿性增加胰岛素分泌以维持血糖稳态。β细胞逐步衰竭,发展为T2DM。此外,脂因子分泌改变(如脂联素水平下降)进一步削弱胰岛素敏感性及抗炎保护作用,加剧代谢紊乱。在胰腺局部,脂肪因子失衡可直接损害β细胞功能,形成“胰岛素抵抗-β细胞损伤”的恶性循环[4]。
肥胖也与1型糖尿病(T1DM)有双向作用,T1DM患者因需依赖外源性胰岛素控制血糖,常面临体重增加的风险。同时,肥胖本身带来的慢性炎症、胰岛素抵抗及代谢紊乱环境可能加速T1DM的病理进程[5]。
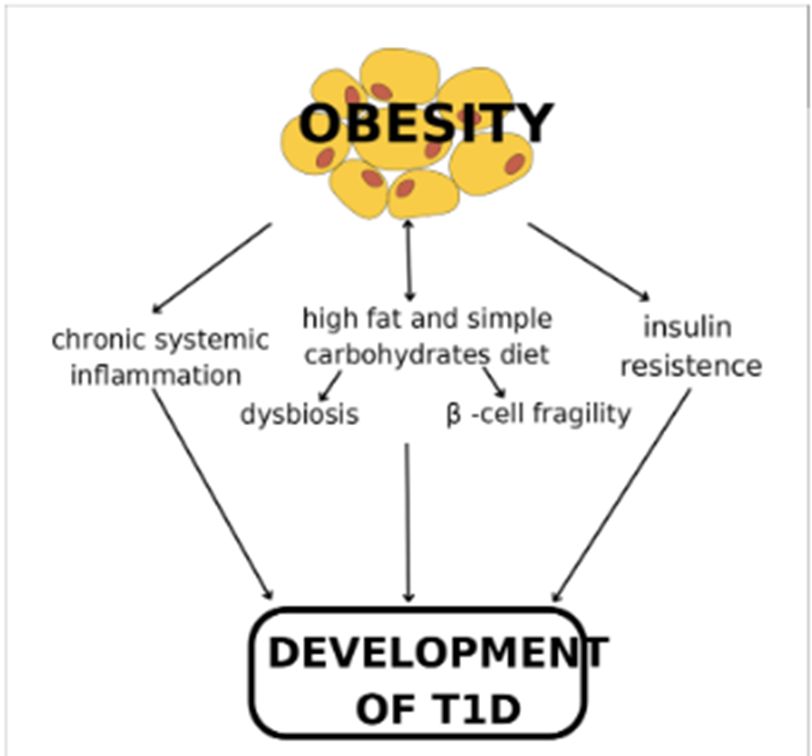
Can type 1 diabetes be an unexpected complication of obesity? Front Endocrinol (Lausanne). 2023 Mar 31;14:1121303. doi: 10.3389/fendo.2023.1121303.
02.派思维新肥胖动物模型研究
由于肥胖与糖尿病在流行病学及病理机制上的紧密关联与复杂交互,建立适宜的动物模型对深入揭示其相互作用机制、探索预防策略及评估潜在治疗方案至关重要。常用模型主要使用啮齿类动物(大小鼠),其代谢特征与人类具有较高相似性,肥胖模型和糖尿病模型在构建原理与方法上存在一定的重叠,这反映了疾病本身的密切联系。
2.1 肥胖动物模型
饮食诱导肥胖(DIO)模型[6]:
原理:通过长期喂食高脂饲料(HFD)模拟人类能量摄入过剩,逐步诱导肥胖及相关代谢异常,高度模拟人类肥胖的病理生理过程。目前广泛应用于减肥药物临床前评价及肥胖机制研究。
建模方法:
DIO小鼠:SPF级雄性C57BL/6小鼠,60%高脂饲料喂养8-12周。通常8周后体重平均增长率>50%,模型稳定(11-18周)。表型:体重显著增加,伴血糖、血脂升高及肝功能异常。
DIO大鼠:SPF级雄性SD或Wistar大鼠,45%高脂饲料喂养8周以上。

体重变化:
不仅仅是一个简单的“吃胖”模型,而是再现了从能量正平衡开始,到脂肪组织重构、系统性炎症、神经内分泌失调和肠道菌群紊乱等一系列复杂的病理生理过程。
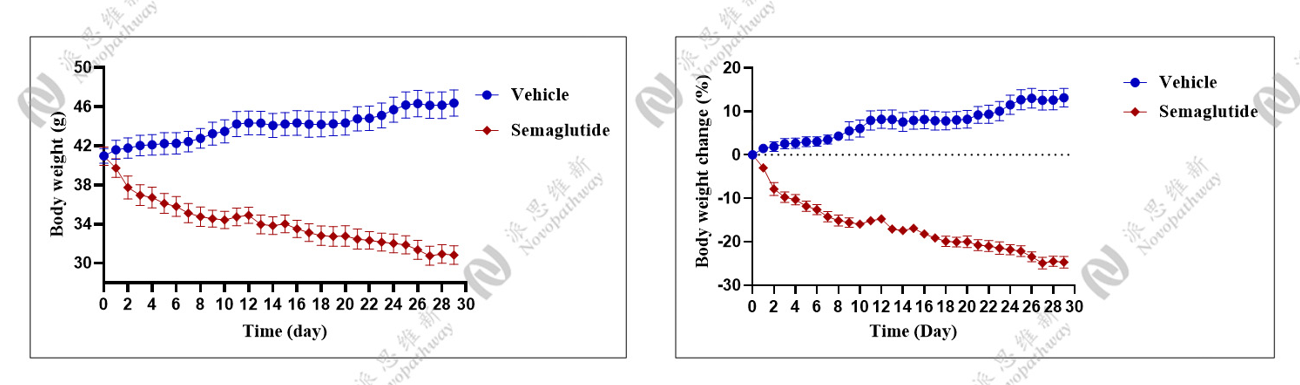
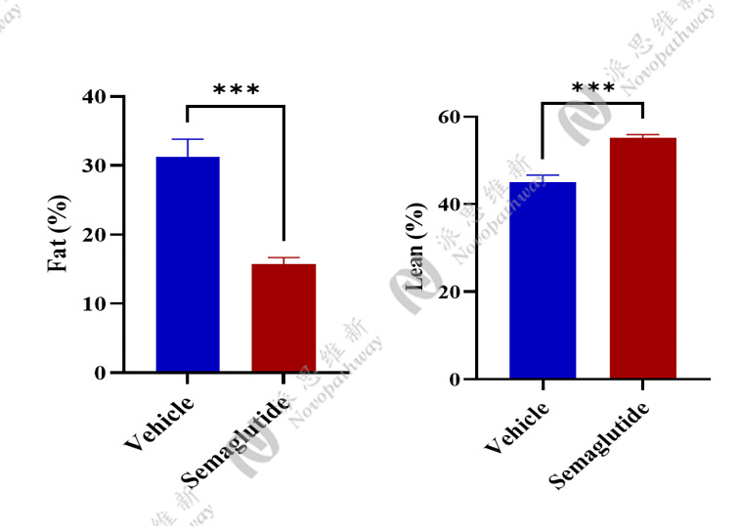
体成分分析:
病理HE染色:
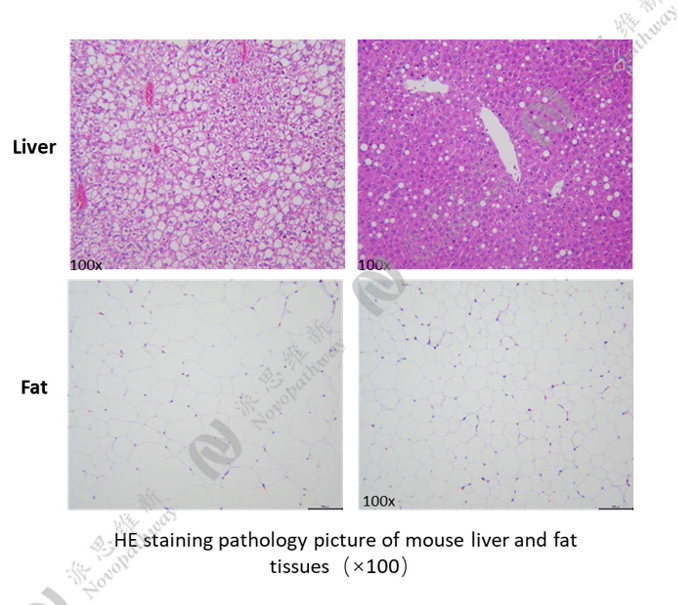
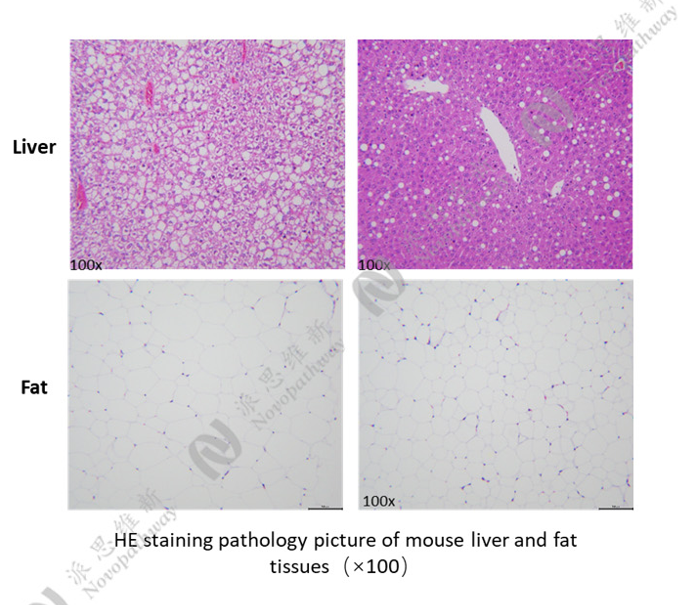
优势:成本低、成功率高、重复性好,病理机制贴近人类。
遗传性肥胖模型[4]:
原理:利用特定基因突变(如瘦素系统缺陷)自发产生肥胖及相关代谢表型(食欲亢进、高脂血症、胰岛素抵抗)。
代表性模型:
ob/ob小鼠(瘦素基因突变):表现为重度肥胖(尤以性腺及棕色脂肪组织显著堆积为特征)、严重胰岛素抵抗、脂肪肝及糖尿病。
db/db小鼠(瘦素受体基因突变):肥胖程度相对较轻(皮下脂肪增量显著),脂肪细胞分化缺陷明显,皮下脂肪炎症反应加剧,较早出现β细胞功能衰竭,出现接近人类T2DM晚期的表型。
03.未来展望
中国GLP-1药物市场正在经历从“仿制跟进”到“源头创新”的华丽转身。信达生物、恒瑞医药、豪森药业等企业处于第一梯队。2025年中国将拥有多款自主研发的长效、双靶点GLP-1药物,不仅能满足国内巨大的医疗需求,更有潜力参与全球竞争,成为全球GLP-1领域的重要力量。
撰稿人:汪云霞、赵英甫
[1] GBD 2021 Risk Factor Collaborators. “Global Burden of 88 Risk Factors in 204 Countries and Territories, 1990–2021: a systematic analysis for the Global Burden of Disease study 2021”. Lancet. 2024; 403:2162-2203.
[2] Okunogbe et al., “Economic Impacts of Overweight and Obesity.” 2nd Edition with Estimates for 161 Countries. World Obesity Federation, 2022.
[3] Piché ME, Tchernof A, Després JP. Obesity Phenotypes, Diabetes, and Cardiovascular Diseases. Circ Res. 2020 May 22;126(11):1477-1500. doi: 10.1161/CIRCRESAHA.120.316101. Epub 2020 May 21. Erratum in: Circ Res. 2020 Jul 17;127(3):e107. doi: 10.1161/RES.0000000000000421. PMID: 32437302.
[4] Kleinert M, Clemmensen C, Hofmann SM, Moore MC, Renner S, Woods SC, Huypens P, Beckers J, de Angelis MH, Schürmann A, Bakhti M, Klingenspor M, Heiman M, Cherrington AD, Ristow M, Lickert H, Wolf E, Havel PJ, Müller TD, Tschöp MH. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 2018 Mar;14(3):140-162. doi: 10.1038/nrendo.2017.161. Epub 2018 Jan 19. PMID: 29348476.
[5] Oboza P, Ogarek N, Olszanecka-Glinianowicz M, Kocelak P. Can type 1 diabetes be an unexpected complication of obesity? Front Endocrinol (Lausanne). 2023 Mar 31;14:1121303. doi: 10.3389/fendo.2023.1121303. PMID: 37065759; PMCID: PMC10102381.
[6] Heydemann A. An Overview of Murine High Fat Diet as a Model for Type 2 Diabetes Mellitus. J Diabetes Res. 2016;2016:2902351. doi: 10.1155/2016/2902351. Epub 2016 Jul 31. PMID: 27547764; PMCID: PMC4983380.
[7] Pandey S, Dvorakova MC. Future Perspective of Diabetic Animal Models. Endocr Metab Immune Disord Drug Targets. 2020;20(1):25-38. doi: 10.2174/1871530319666190626143832. PMID: 31241444; PMCID: PMC7360914.
[8] Goyal SN, Reddy NM, Patil KR, Nakhate KT, Ojha S, Patil CR, Agrawal YO. Challenges and issues with streptozotocin-induced diabetes - A clinically relevant animal model to understand the diabetes pathogenesis and evaluate therapeutics. Chem Biol Interact. 2016 Jan 25;244:49-63. doi: 10.1016/j.cbi.2015.11.032. Epub 2015 Dec 2. PMID:
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




