- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

医疗器械生物学评价的“三步法”:从材料表征到动物实验
前言
医疗器械的安全性直接关系到患者的生命健康,而生物学评价是评估医疗器械安全性的核心环节。随着国内外监管要求的日益严格,系统化、科学化的评价流程显得尤为重要。
在医疗器械研发领域,生物学评价是确保产品安全性的关键环节,其系统化的“三步法”评价路径帮助企业科学高效地评估产品风险,同时符合伦理与法规要求。
医疗器械的生物学评价并非简单地按顺序进行测试,而是一个基于风险管理的、科学的决策过程。其核心依据是GB/T 16886.1/ISO 10993.1标准。整个评价过程可以概括为三条主要的路径,其核心决策流程如下图所示,评价人员需依据产品具体情况循证决策:
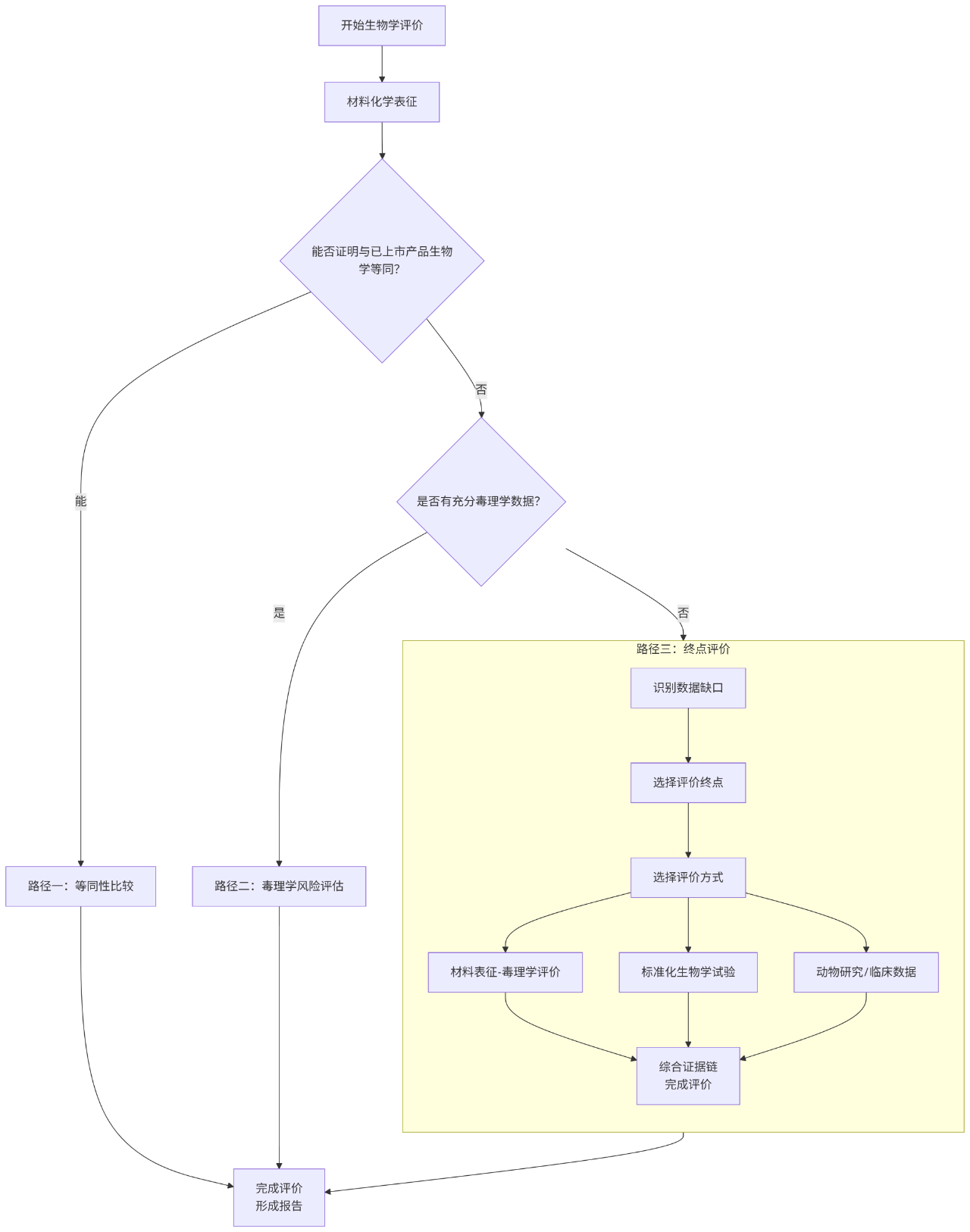
该流程图清晰地展示了生物学评价的系统性方法:
优先利用材料表征数据进行等同性比较或毒理学评估,以尽可能减免不必要的实验;仅在无法通过前两种路径充分证明安全性时,才考虑进行终点评价,包括必要的生物学试验。
01 第一步:材料表征与等同性比较
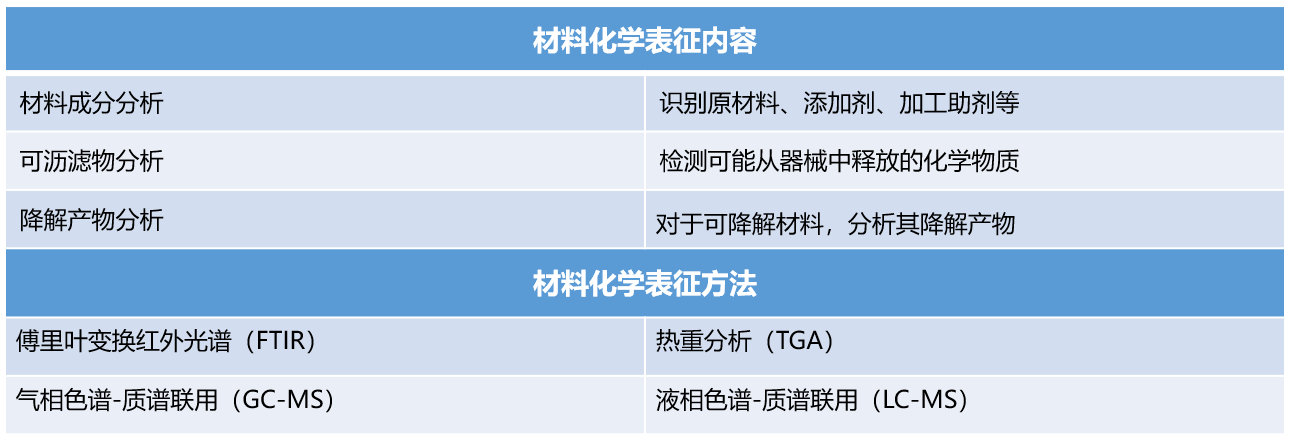
材料表征是生物学评价的基石。根据GB/T16886.18/ISO10993-18,材料化学表征主要目的是全面了解医疗器械所用材料的化学成分,需要对医疗器械的原材料、添加剂、工艺污染物和残留物、可沥滤物、降解产物等进行定性和定量分析。材料表征提供了评价的基础数据,是后续毒理学风险评估和生物学试验的依据。
1.1 材料表征
根据标准要求,材料表征至少需包含以下一个或多个方面:
- 公认的材料化学名称
- 材料理化特性信息(如密度、熔点、分子量分布等)
- 从供应方获取的材料成分信息
- 加工助剂的成分信息(如模具润滑剂、脱模剂等)
- 化学分析(利用FTIR、GC-MS、LC-MS等仪器分析方法)
- 相关标准(如符合ISO、ASTM或其他药典标准)
仪器分析(如GC-MS、LC-MS)对于可沥滤物研究至关重要,其目的是模拟实际使用条件,提取并鉴定可能从器械中迁移至人体的化学物质,并确定分析阈值(AET)。
材料化学表征是生物学评价的基础,主要包括以下内容:
派思维新分析实验室

1.2 等同性比较
等同性比较是评价流程中的关键环节。等同性概念并非要求材料完全相同,而是要求所选材料的毒理学或生物学安全性不低于同类临床已接受材料的安全性。通过与已上市产品在材料配方、加工工艺、灭菌方式、几何特性、物理特性以及人体接触方式等方面进行比较,成功证明等同性可以减免不必要的试验,从而节省大量的人力、经费和时间成本。
可以通过与已上市产品比较,证明生物学安全性等同:

02 第二步:毒理风险学评估
如果不能证明等同性,评价将进入第二条路径:利用已有毒理学数据进行风险评估。毒理学风险评估是利用现有数据评价医疗器械安全性的高效方法。GB/T16886.17/ISO10993-17提供了毒理学评价的指导[1]。评价中需要关注可沥滤物或可浸提物中靶物质的毒理学风险,运用可耐受摄入值(TI)、毒理学关注阈值(TTC)等毒理学概念进行评估[1]。正确使用这些工具,可以对医疗器械可沥滤物中的化学物质进行风险评估,为豁免不必要的生物学试验提供可靠证据。
毒理学风险评估是基于材料表征数据进行的系统性评价:

当可以获得充分信息对医疗器械或材料进行毒理学风险评定时,试验通常是不必要的[1]。这要求评价人员具备丰富的毒理学知识背景,能够正确分析数据的适用性和可靠性。
毒理学风险评估尤其适用于评价系统性毒性终点,如全身毒性、遗传毒性、生殖毒性和致癌性等[1]。
03 第三步:终点评价与补充测试
如果通过前两步仍无法充分证明产品的生物安全性(例如,无法证明等同性且毒理学数据不足),则需要进行终点评价以填补数据缺口。根据GB/T16886.1/ISO10993-1中的评价终点矩阵图,需要根据产品与人体接触的途径和时间确定需要评价的终点[1]。
3.1 评价终点选择
根据ISO 10993-1附录A,基于接触途径和接触时间选择评价终点:

3.2 评价方式选择
确定终点后,通常有以下三种评价方式可供选择或组合使用:
3.2.1 材料表征-毒理学评价
此方式适用于评价系统性的毒性终点,如全身毒性、遗传毒性、生殖毒性、致癌性。它也可用于评估加工助剂残留量的可接受性,或产品变更是否引入新的生物学风险。当生物学试验的不确定度很高时,可以作为补充,但一般不用于评价细胞毒性、致敏、植入后局部反应、血液相容性等终点[1]。
3.2.2 标准化的生物学试验
采用终产品或有代表性的样品作为试验材料,使用浸提液或直接接触进行试验。试验的关键在于质量控制,例如确保样品能代表最差情况、选择适当的浸提条件(浸提介质、温度、时间、比例),并设置阴性对照和阳性对照。对于药械组合产品,可能需要将终产品和不含药部分分别进行评价。
3.3 动物研究/临床数据
动物研究(此处指模拟临床使用的原位动物实验)主要用于医疗器械临床前可行性、有效性和安全性研究,虽然不能充分识别所有生物学风险,但在某些情况下可以补充生物相容性评价。
临床数据虽然是最接近医疗器械真实应用的数据,但由于样本量、观测方式等因素限制,对于生物学风险的识别可能不敏感,因此通常不能直接用于生物相容性评价,但可作为有益补充。
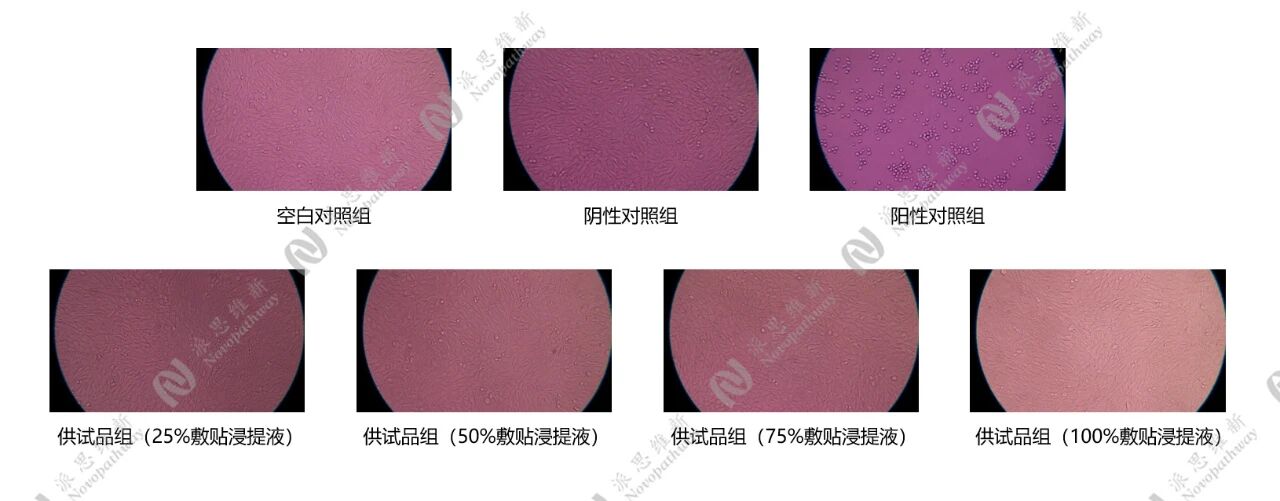
通过无菌操作将供试品在含10% FBS的DMEM培养基中浸提,于37℃、60 rpm 条件下孵育72h,制备供试品浸提液。将细胞悬液铺板培养24h后,换不同的浸提液进行培养16h后,在显微镜下观察细胞形态,使用MTT法检测各孔吸光度。
通过对细胞毒性评价和分级,供试品浸提液对细胞毒性判定级别为0级,不超过2级(轻度毒),判为合格。
用终产品或代表性样品,按其临床最差使用条件进行浸提后试验。
采用终产品或有代表性的样品作为试验材料,使用浸提液或直接接触进行试验。试验的关键在于质量控制,例如确保样品能代表最差情况、选择适当的浸提条件(浸提介质、温度、时间、比例),并设置阴性对照和阳性对照。对于药械组合产品,可能需要将终产品和不含药部分分别进行评价。
04 动物实验的特殊考量
若经过评估,必须通过动物实验来验证器械的安全性(特别是植入器械),则需要严格的设计和执行。
4.1 植入实验的关键设计要素

4.2 组织病理学评价
动物实验后,组织病理学评价是核心。需依据ISO 10993-6提供的计分系统,对受影响组织进行半定量评价。评价指标包括:
- 纤维化/纤维囊腔厚度
- 炎症程度和炎性细胞类型(中性粒细胞、淋巴细胞、巨噬细胞等)的数量和分布
- 坏死的存在、程度和类型
- 其他组织改变(如血管形成、脂肪浸润、肉芽肿、钙化)
- 材料参数(如破裂、碎片存在、降解材料残留物的形状和位置)
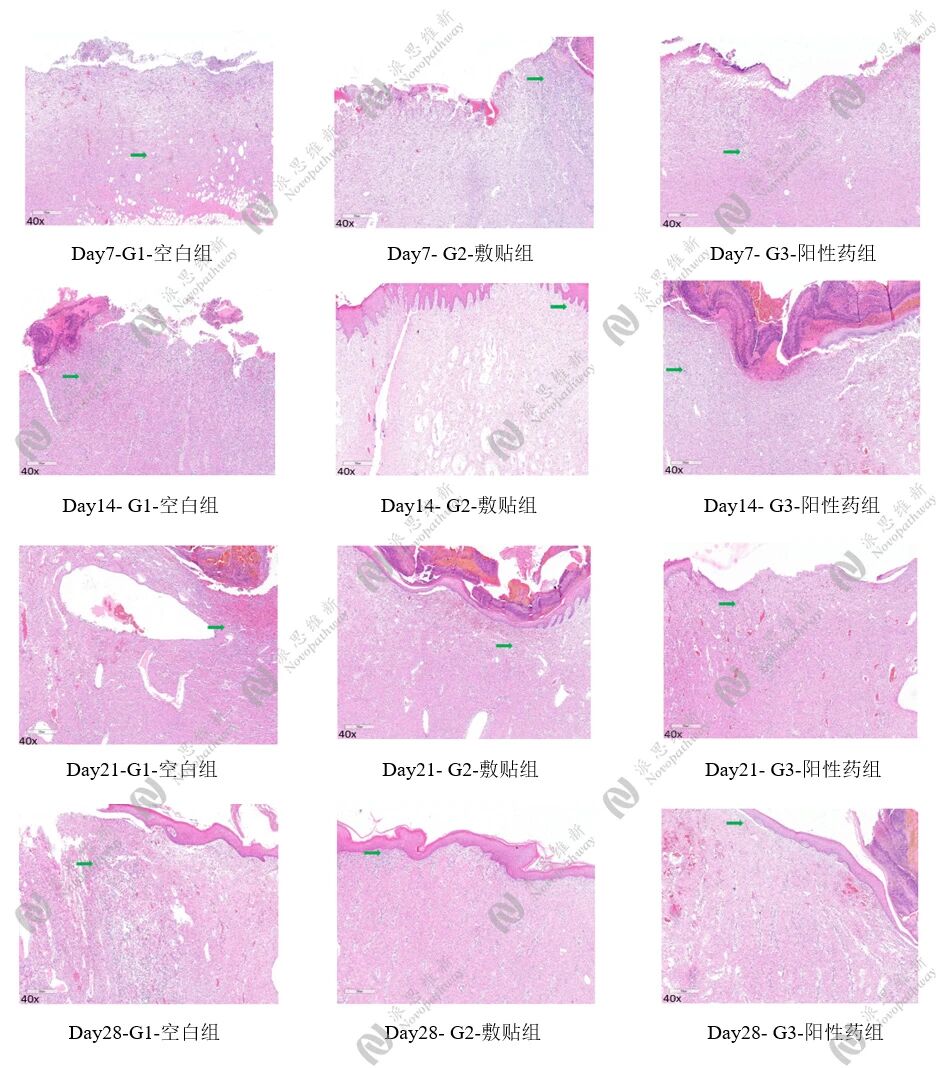
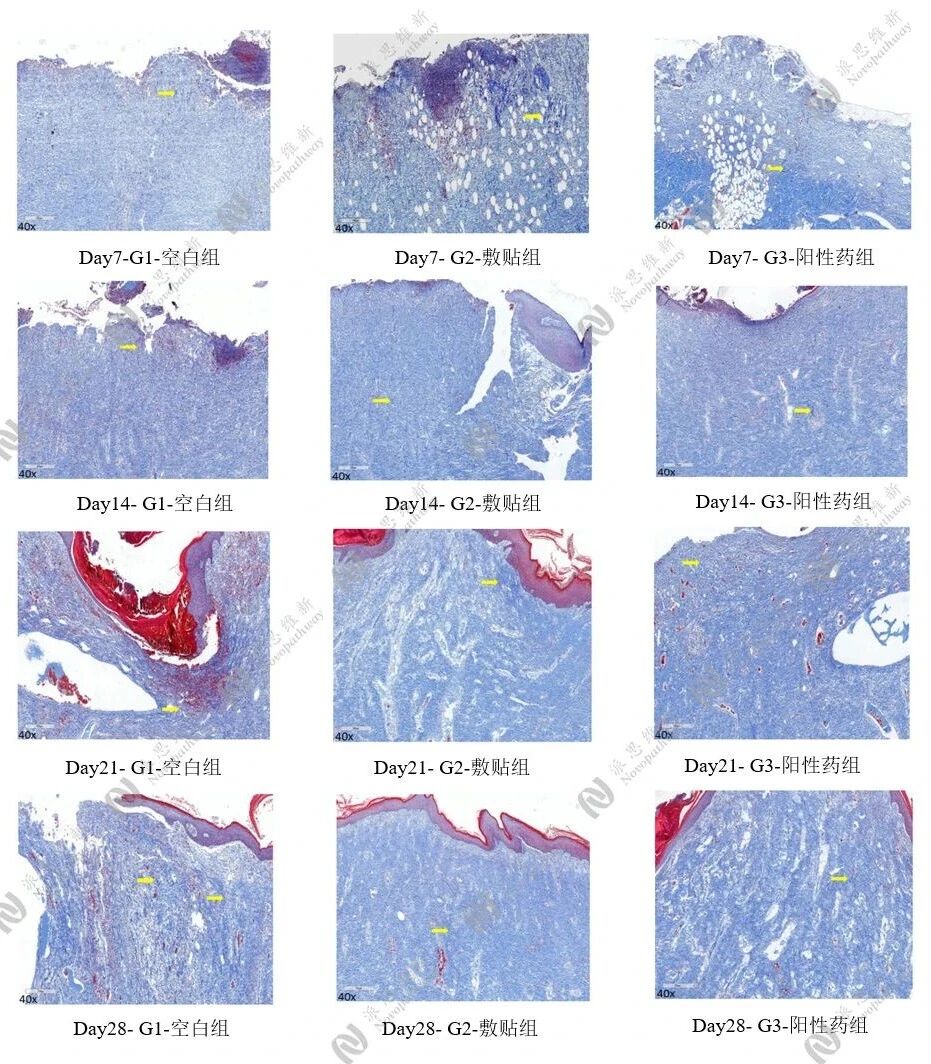
4.3病理:伤口愈合模型
皮肤组织固定后包埋切片做H&E染色观察并成像,Masson染色,评估胶原纤维含量。结果显示,与空白组对比,可见敷贴组处于修复状态,且有胶原沉积。
H&E 染色结果图
Masson染色结果图
05 生物学评价的生命周期管理
医疗器械的生物学评价需要覆盖整个产品生命周期。当产品设计、生产工艺、原材料供应商、贮存运输条件或临床预期用途发生变化时,可能需要重新进行生物学评价[7][9]。
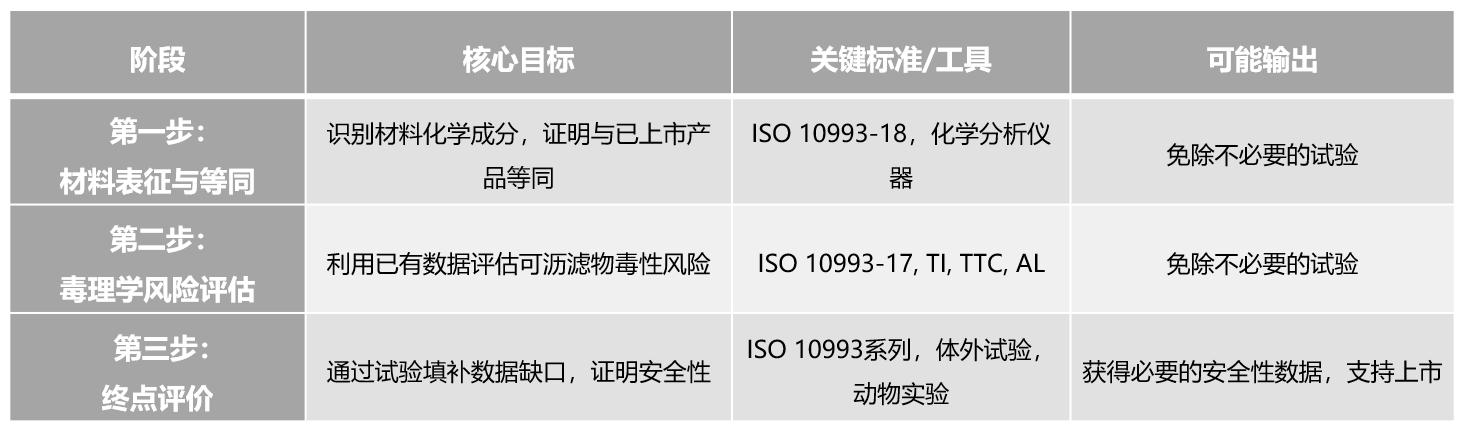
“三步法”评价路径(如下表总结)提供了一个基于风险、科学且合乎伦理的框架,旨在通过充分的材料表征和毒理学评估,最大限度地减少不必要的动物实验,同时在需要时通过科学可靠的实验数据确保医疗器械的最终安全。
建立材料变更可追溯机制,充分利用已有数据和信息,可以降低评价成本,同时保证器械的安全性和市场竞争力[9]。
5.1免于动物试验的条件
在以下情况下,可能不需要进行动物试验[9]:
1.材料等同性证明:通过化学表征证明新材料与已上市产品成分一致;
2.临床使用历史支持:有文献证明材料在同类器械中安全使用5年以上且无不良反应报告;
3.制造和灭菌一致性:制造和灭菌工艺的变化经过验证不影响生物安全性。
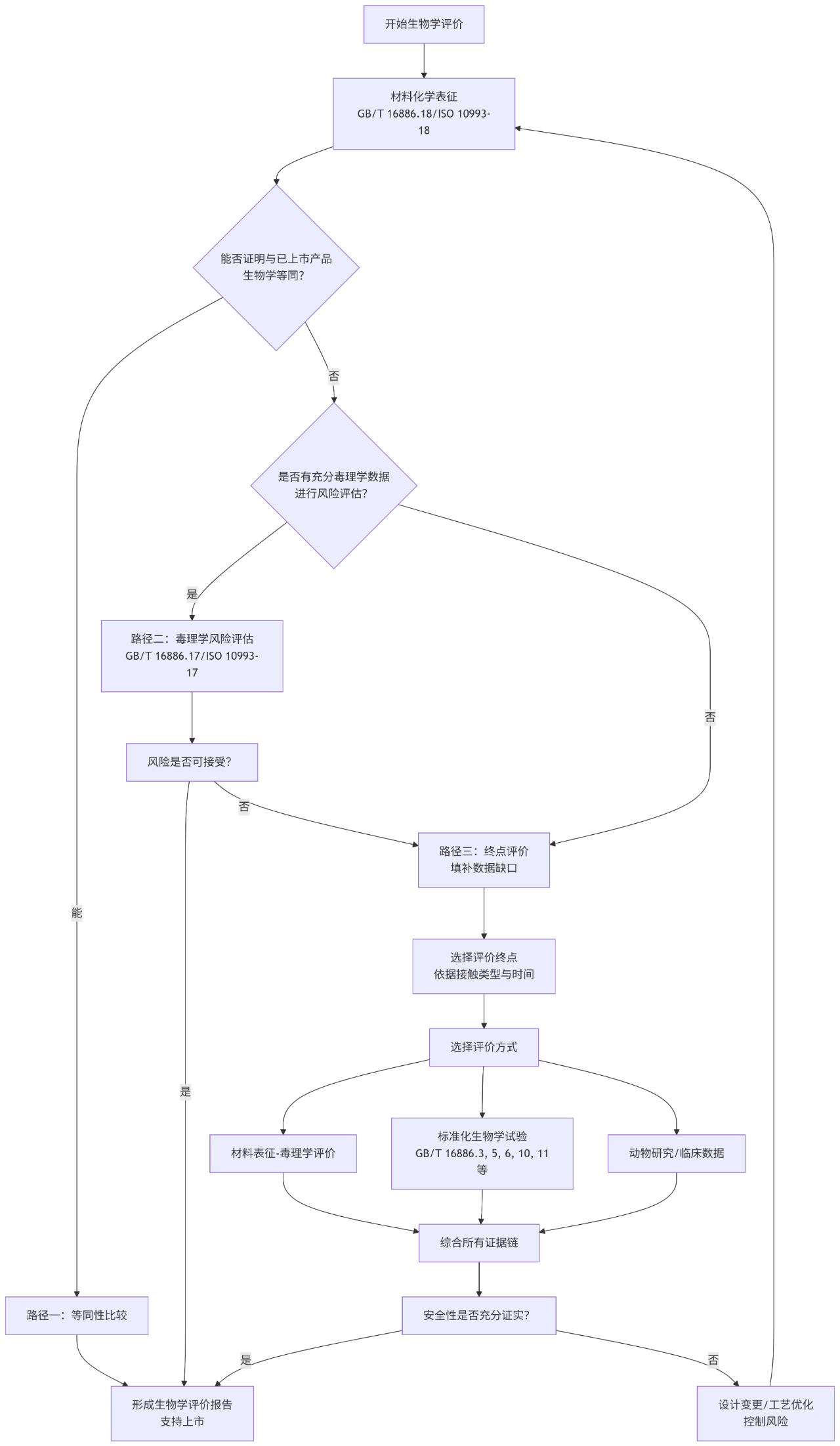
5.2生物学评价决策路径图
下图总结了医疗器械生物学评价的完整决策路径,体现了从材料表征到最终评价结论的全过程,以及各路径之间的逻辑关系:
06 未来发展趋势
医疗器械生物学评价正朝着更加科学和动物友好的方向发展。体外实验因操作可控性强、影响因素单一、重复性好而得到大力发展,通过体内-体外实验的相关分析有望部分代替体内实验[3]。先进分子生物学技术的应用使评价向细胞和分子水平迈进,最终目标是建立医疗器械对分子、细胞、机体相互作用的系统性评价体系。
07 结语
医疗器械生物学评价的“三步法”提供了一个系统、科学的评价路径,帮助企业在保证产品安全性的同时,提高研发效率,降低评价成本。正确的生物学评价不仅是监管要求,更是企业社会责任和专业精神的体现。随着新技术、新材料的不断涌现,生物学评价的方法和理念也将持续发展。需要密切关注法规变化,建立完善的评价体系,确保医疗器械的安全有效,最终造福广大患者。
参考文献
1.GB/T 16886.1-2022/ISO 10993-1:2018《医疗器械风险管理对医疗器械的应用》
2.GB/T 16886.18-2022/ISO 10993-18:2020《医疗器械生物学评价第18部分:材料化学表征》
3.GB/T 16886.17-2022/ISO 10993-17:2020《医疗器械生物学评价第17部分:毒理学风险评估》
4.《医疗器械生物学评价和审查指南》
5.FDA Guidance for Industry: Use of International Standard ISO 10993-1
7. 医疗器械生物学评价的重点及趋势
9. 医疗器械生物学评价技术审评要点与常见问题深度解析



上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




