- 关于我们
- 一站式服务
- 技术平台
临床研究
临床中心实验室
临床样本病理学检测
蛋白水平检测分析
免疫学细胞表现分型分析
药物毒性检测-CRS
TMB / 免疫微环境检测
血液疾病分型检测,类型鉴定
MRD(Minimal Residual Disease)
CART/TCRT/ADC/mAb/BisAb/
临床前研究
肿瘤疾病研究平台
小分子耐药模型
原位及转移模型
肿瘤模型 | 人源化小鼠
炎症&自身免疫疾病研究平台
脓毒症、多发性硬化症模型
炎症性肠病模型
系统性红斑狼疮、肾病模型
腹泻模型精神与神经系统:疾病研究平台
阿尔茨海默症、帕金森庄模型
疼瘾、抑郁证模型
精神分裂症、脑卒中、高血压模型
代谢疾病研究平台
肝纤维化、酒精性肝炎模型
非酒精性脂肪性肝炎(NASH)模型
急性肝损伤、肥胖模型
关节和骨疾病研究平台
关节炎、痛风,性关节炎、骨质疏松症模型
类冈湿关节炎模型
呼吸系统疾病研究平台
慢性组塞性肺病(COPD)模型
急性肺损伤模型
哮喘、肺纤维化模型
肺炎链球菌、肺支原体感染模型
肺铜绿盛染、肺曲霉感染模型
心血管系统疾病研究平台
高血压、高血脂模型
衰老、动脉粥样通化、缺血性脑损伤模型
皮肤系统疾病研究平台
银屑病、系统性硬化症模型
雄秃、斑秃模型
特应性皮炎、痤疮模型
医疗器械评价研究平台
全身毒性试验/急性、亚急性、亚慢性和慢性毒性试验
生物相容性评估
医美产品医疗器械有效性,安全性评估
药代动力学、安评
体内DMPK研究、体内DMPK研究
急毒,长毒,一般毒理
安全毒理、免疫原性评价
免疫毒性评价、非GLP毒理
- 加入我们
- 联系我们
news

如何构建更接近临床的胰腺癌(Pancreatic Cancer、PDAC)动物模型?
01 前言
胰腺癌(pancreatic cancer,PC)是一种起源于胰腺组织的恶性肿瘤,被称为“癌中之王”,在癌症相关死亡原因中排第七,在人类发展指数较高的国家,预计到2030 年胰腺癌将成为癌症死亡的第二大原因。胰腺癌确诊后的五年生存率约10%,是预后最差的恶性肿瘤之一。近几十年来,随着经济水平和社会的发展,中国的胰腺癌发病率呈现逐年上升的趋势。
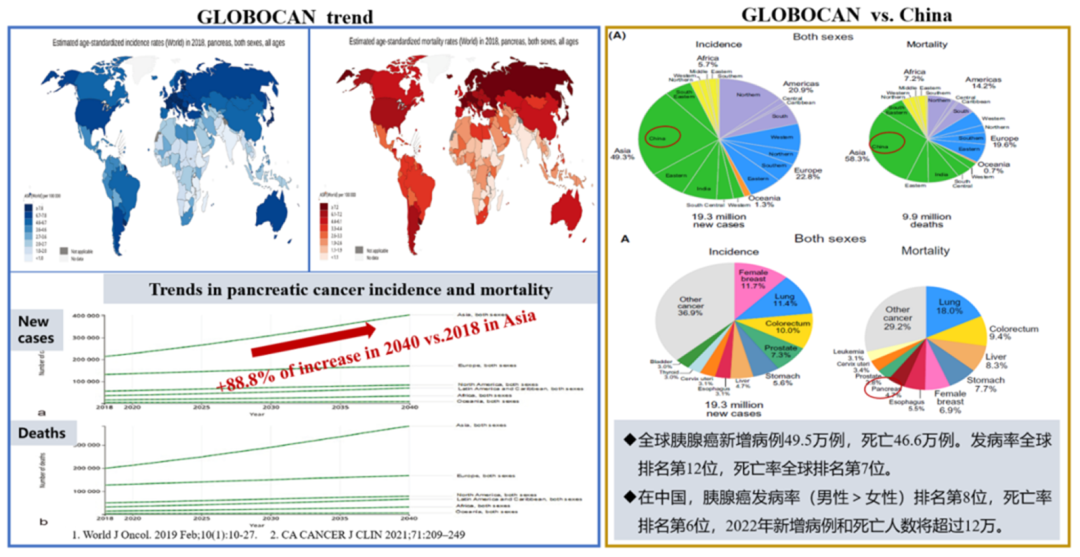
胰腺癌起源于胰腺组织,主要分为两类,分别起源于胰腺导管上皮细胞及腺泡细胞。胰腺癌起病隐匿、恶性程度高、化疗反应差、转移倾向高、疾病进展快,从解剖学来看胰腺位于肝脏、胃、脾的内侧,紧贴脊柱,位于腹腔中心,局部治疗难度大、手术肿瘤切除率低,因此PC极易复发、预后极差[1]。胰腺癌发生过程中,细胞的染色体损伤修复中累积KRAS、TP53等基因突变,最终形成癌症,半数以上胰腺癌位于胰头,约90%是起源于腺管上皮的管腺癌(PDAC)。
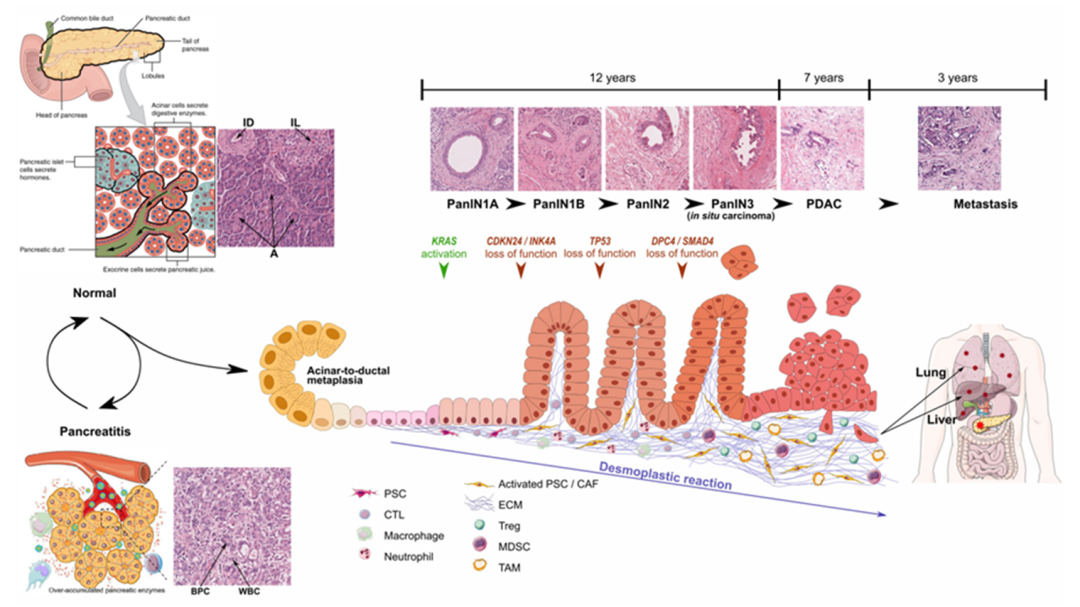
对于不同分期及进展程度的胰腺癌患者有不同的治疗方案,mFOLFIRINOX化疗、手术切除、综合治疗是胰腺癌最主要治疗方法。但大多数胰腺癌患者发现时已失去了手术机会。目前,治疗不可切除的局部晚期或转移性胰腺癌的常用化疗药物包括:吉西他滨、白蛋白结合型紫杉醇、5‑FU/LV、顺铂、奥沙利铂、伊立替康、替吉奥、卡培他滨;靶向药物包括厄洛替尼、依维莫司、舒尼替尼等。
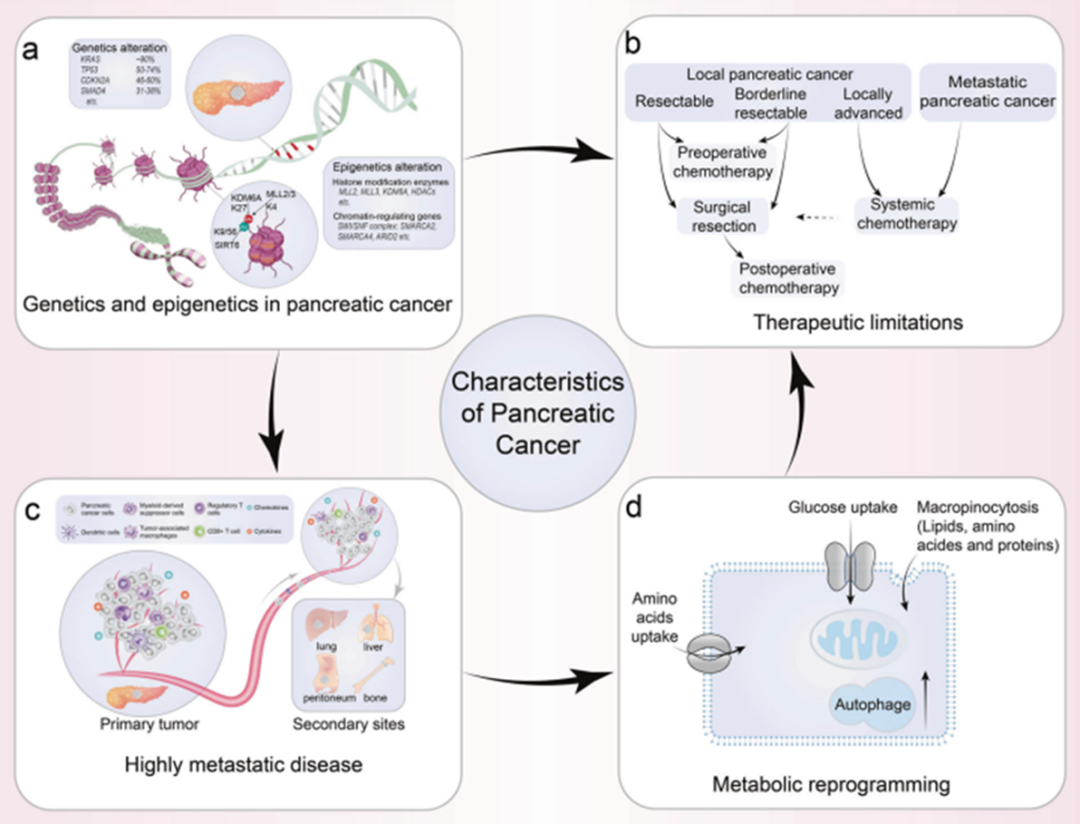
尽管全世界都在努力寻找新的治疗方法,但PC生存率在过去的几十年基本没有变化,这表明需要更多的研究来了解这种癌症的特征。癌症的分子病理学的差异,实质上影响了 PC的临床特征。分子亚型可以指导多种癌症的临床前实验研究和临床治疗,在治疗前预测最佳治疗策略会改善患者的整体预后,将复发率和成本降至最低。

基于基因组,2011年Collisson通过RNA微阵列分析将胰腺癌分为经典型,准间质型,外分泌型。经典型胰腺癌高表达上皮细胞标志物及黏附基因(如GATA6、KRAS),对化疗较敏感,准间质型胰腺癌高表达间质基因(如MYC、TP53),肿瘤细胞向间质细胞转化,具有更强的转移和入侵的能力,并具有干细胞特征、凋亡与衰老减少,免疫抑制增强,侵袭性强,预后差,相比经典型胰腺癌MST短(26.2个月vs. 10.1个月,P=0.038)。外分泌型比较罕见,一般认为是分泌胰液的胰泡细胞癌化,恶性程度居中。尽管基于组织病理学的组织病理学标准的临床决策在许多癌症类型中都很成熟,但胰腺癌的亚型为治疗决定提供信息还未成熟[2]。
02 如何选择合适的动物模型
由于胰腺癌的异质性很强,理解这种疾病,识别和测试新的疗法,并协助识别生物标志物,都需要更精准的临床前动物模型[3]。90%的胰腺癌均有KRAS的突变,正常的KRAS基因可抑制肿瘤细胞生长,而一旦发生突变,它就会持续刺激细胞生长,打乱生长规律,从而导致肿瘤的发生,但KRAS蛋白表面没有适于小分子抑制剂结合的口袋,影响了靶向药物的效果。在KRAS靶向药物开发中(如KRAS G12C抑制剂)可以使用多种动物模型,快速筛选药物活性,验证药物机制,如评估TME内渗透性,进行临床前的转化研究,测试不同KRAS突变亚型响应。
通过构建动物模型,在动物体内模拟胰腺癌发生发展过程,探索肿瘤发生的分子机制,是研究癌症治疗方法必不可少的过程。但单一的动物模型对肿瘤的模拟程度有限,在实际研究中还需结合具体需求选择合适的动物模型,才能更好地达到研究目的。
那么在众多模型中该如何选择合适的呢?
2.1 典型的移植瘤模型
派思维新CDX模型展示:
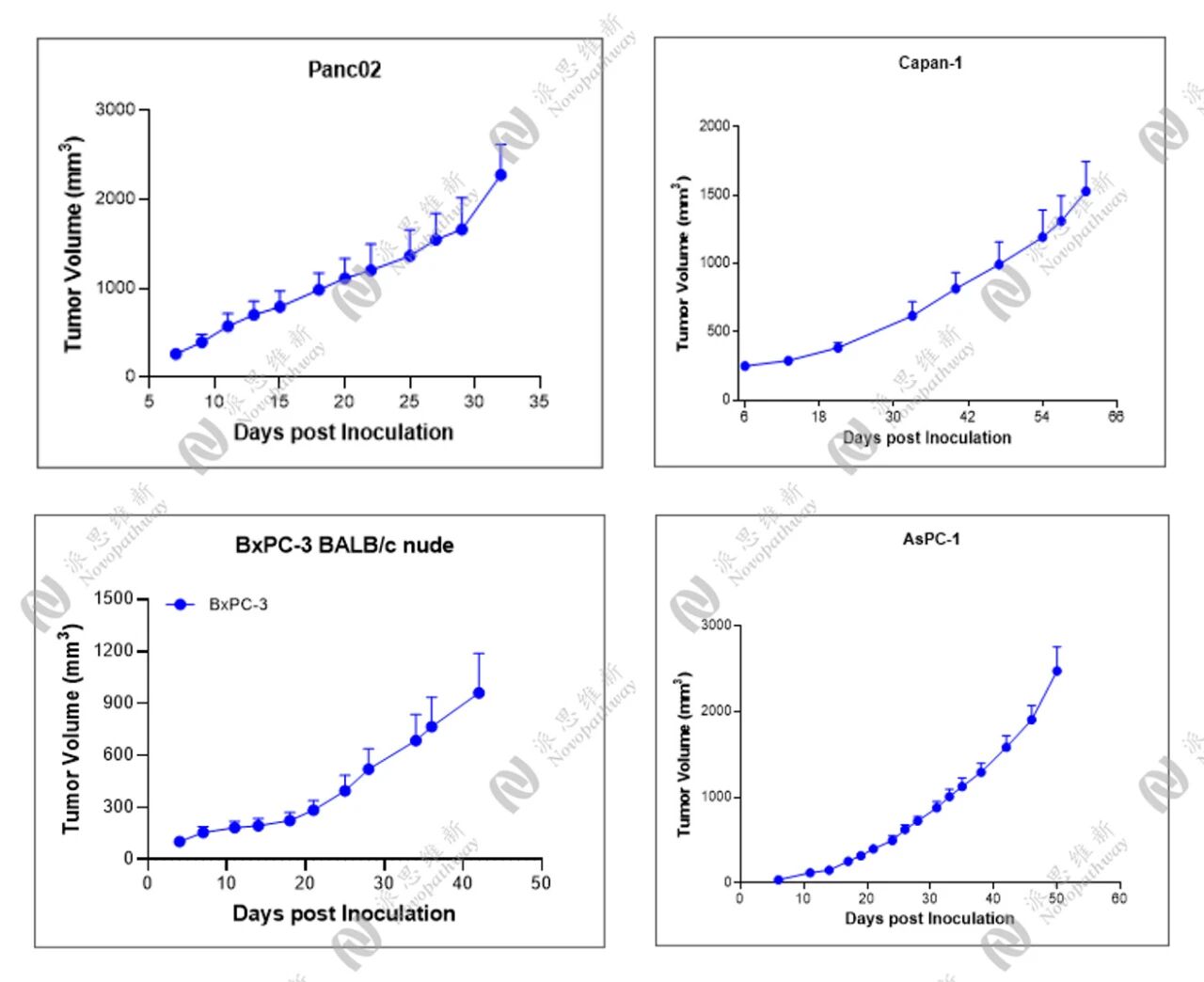
不同结胰腺癌肿瘤细胞的CDX皮下模型
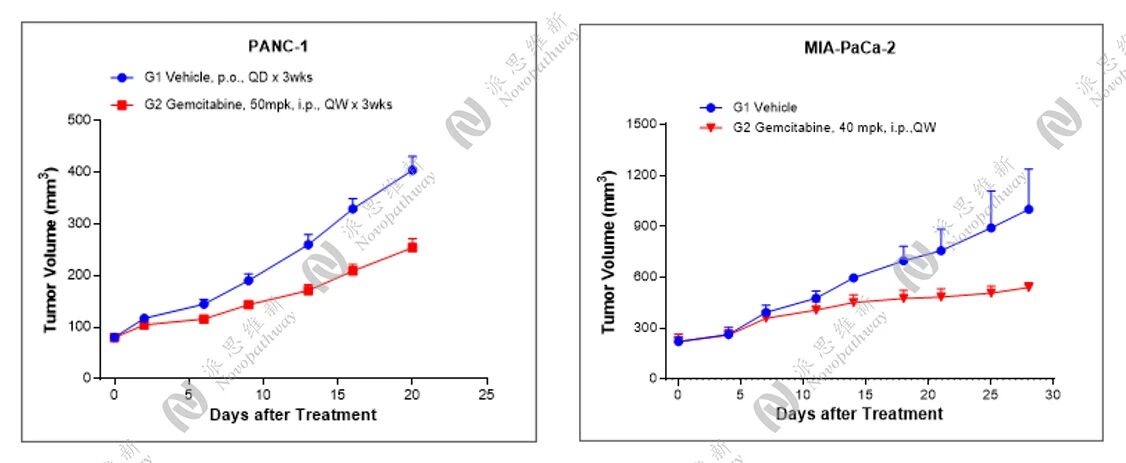
吉西他滨(Gemcitabine)属于细胞周期特异性抗代谢类抗肿瘤药物,进入细胞后,在脱氧胞苷激酶(dCK)的催化下磷酸化,后者继续活化为双氟脱氧胞苷二磷酸(dFdCDP)和双氟脱氧胞苷三磷酸(dFdCTP)活性产物。dFdCTP可抑制DNA多聚酶和dCMP脱氨酶进而抑制DNA的复制,主要作用于G1/S期,从而发挥抗胰腺癌作用;除此之外吉西他滨可在抑制骨髓源性的抑制细胞(MDSC)的同时活化树突状细胞(DC),通过调节机体的免疫系统发挥抗肿瘤效应,适用于胰腺癌肿瘤的治疗。
2.2原位移植瘤模型
相较于传统的皮下移植肿瘤模型,原位移植肿瘤模型可以使用多种方法对药物药效及疾病进展进行评估,包括小鼠的临床症状、生存期、肿瘤体积(仅限乳腺癌原位模型)以及使用活体发光成像技术对荧光素酶标记的肿瘤细胞进行跟踪,可以实现对肿瘤细胞生长、肿瘤细胞分布和转移的实时跟踪。目前累计超过100篇相关文献中报道了10多种原位模型的构建及使用,这些独特的原位移植模型已被用于创新药物发现和机制研究,并作为连接临床前和临床研究与药物开发的桥梁[4]。
派思维新原位模型展示:
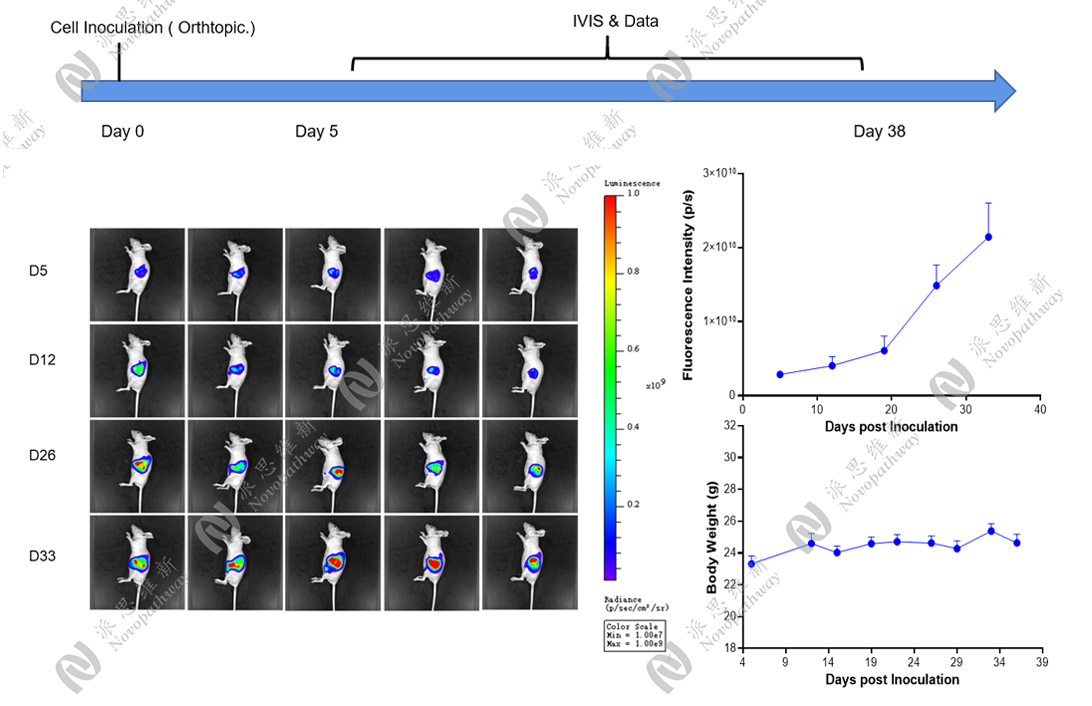
研究发现,PC原位移植小鼠模型保持了人类肿瘤的结构及其原始的抗原表型,能够更真实地反映胰腺癌在体内的发生、发展的过程,以及治疗微环境,为研究提供更为接近临床实际情况的实验平台。

派思维新原位模型成像实验室
2.3免疫缺陷鼠模型
近年来研究者采用多种免疫缺陷型小鼠(肿瘤细胞移植时免疫排斥反应较弱,有利于形成肿瘤)构建移植瘤模型,但免疫缺陷小鼠体内存在多种免疫细胞功能障碍,而大量研究表明,肿瘤微环境与肿瘤的生长具有密切关系[5],所以此类模型可能无法模拟肿瘤细胞生长的微环境,在PC相关研究中存在一定的局限性。
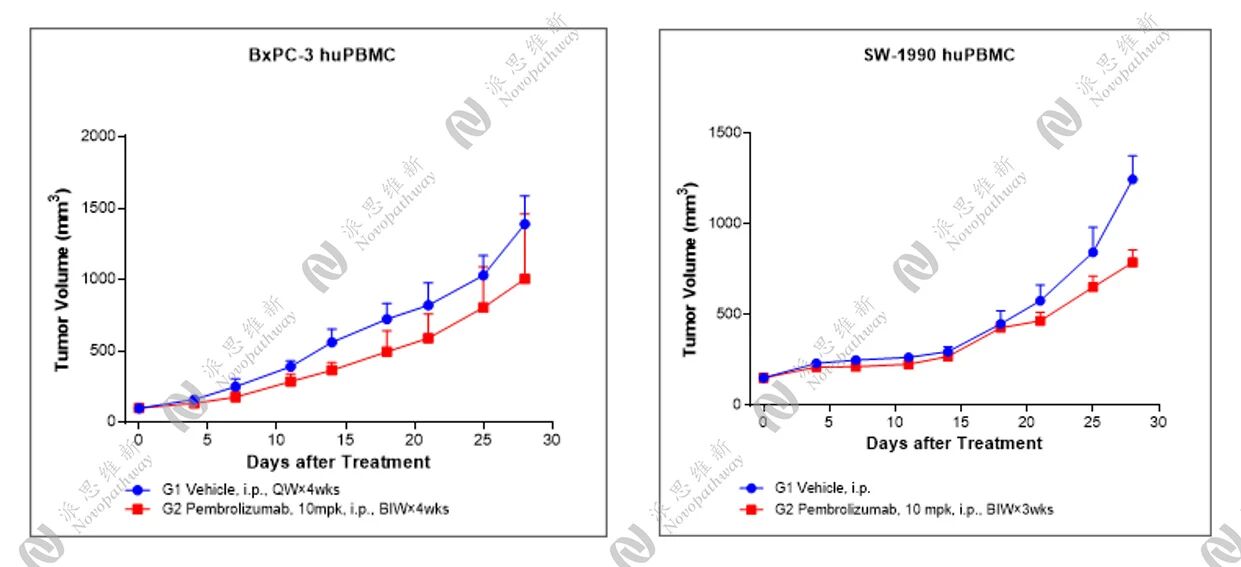
派思维新人源化小鼠模型展示:
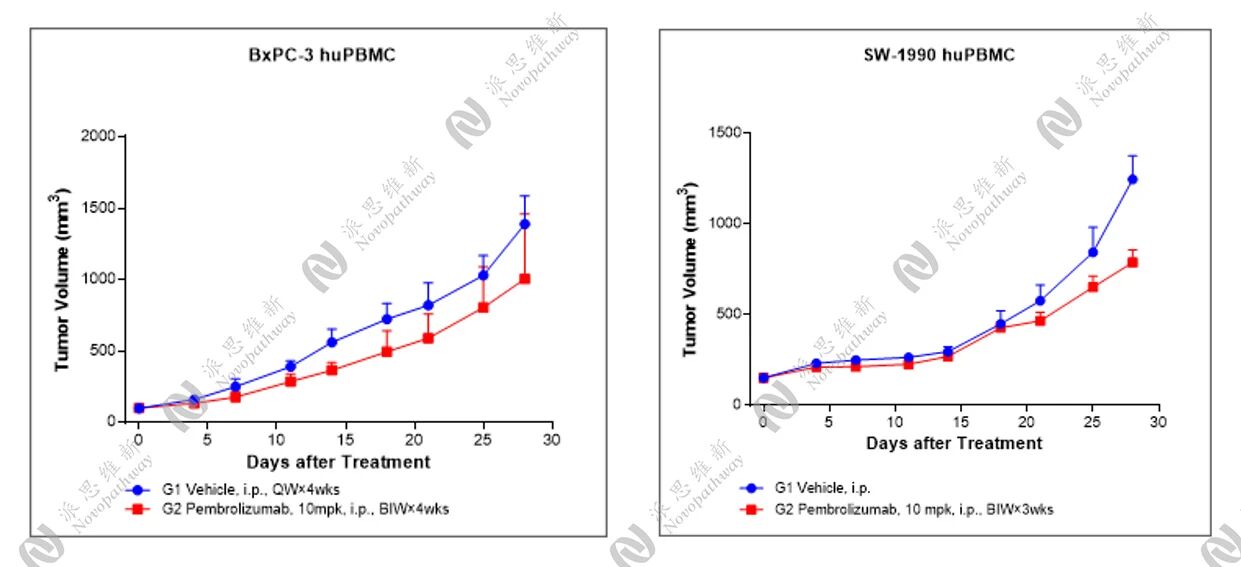
PBMC人源化小鼠模型是通过将人外周血单个核细胞(PBMC)植入免疫缺陷小鼠体内,从而使其重建人类免疫系统的小鼠模型,可有效地重建人类免疫系统,更好地模拟人体免疫特征,有效研究人类肿瘤和免疫系统之间的相互作用。
2.4人源异种移植(patient-derived xenografts, PDX)模型
为解决上述问题,研究者建立了PDX模型, 该模型依赖于将手术或活检获得的人源肿瘤标本直接移植到免疫低下的小鼠体内,当瘤块长至2 cm时,取瘤块移植于另一免疫缺陷小鼠,45 天左右即可成功构建PDX模型。此模型保留了肿瘤内异质性和复杂的微环境, 良好保存了患者肿瘤标本的形态特征,具有更可靠的临床预测价值。
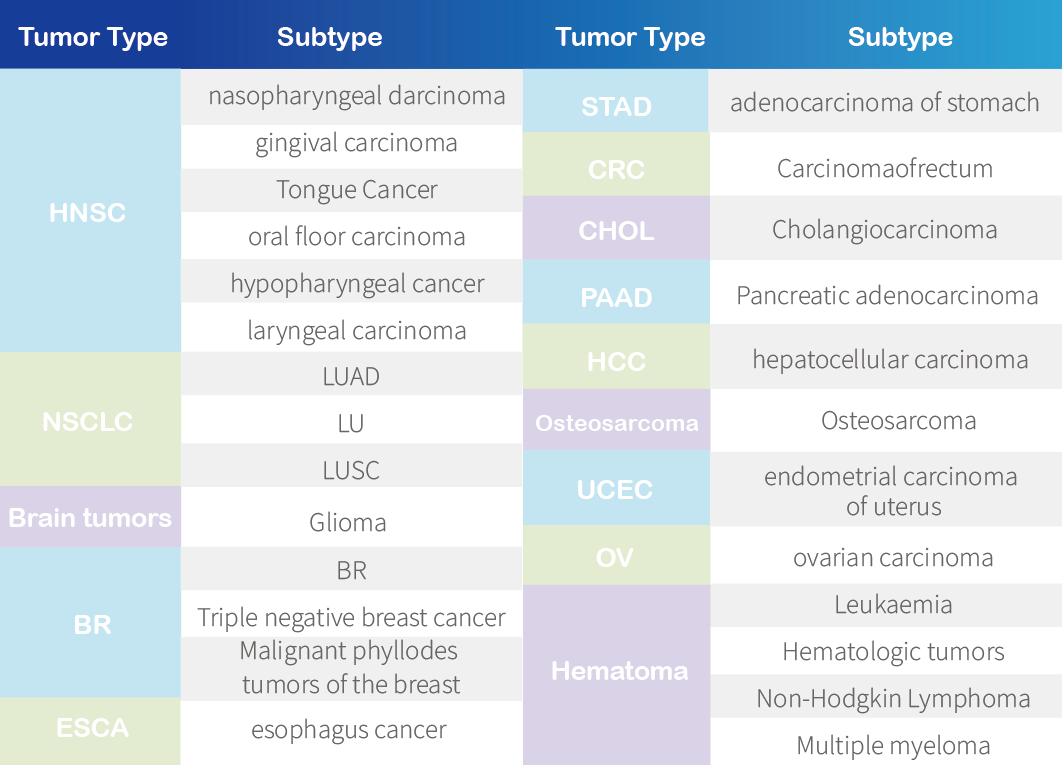
派思维新可做PDX模型list:
参考文献
[1]School of Basic Medicine, Shaanxi University of Chinese Medicine, Xixian NewArea, Shaanxi 712046, China
[2] Molecular subtypes of pancreatic cancer. Nat Rev Gastroenterol Hepatol. 2019 Apr;16(4):207-220.
[3] Modeling pancreatic cancer in mice for experimental therapeutics. Biochim Biophys Acta Rev Cancer. 2021 Aug;1876(1):188554.
[4] Hoffman RM. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 1999;17(4):343-59. doi: 10.1023/a:1006326203858. PMID: 10759402.
[5]PourP,Althoff J,KrugerFW,et al.ApotentpancreaticcarcinogeninSyrianhamstersN-nitrosobis(2-oxopropyl)amine[J].JNatlCancerInst,1977,58(5):1449-1453
上海派思维新生物医药科技有限公司
办公地址:上海市浦东新区华夏东路333号临丰科创园5幢
人力资源 邮箱:HR@novopathway.com 电话:021-5838 0356
BD商务 邮箱:BD@novopathway.com 电话:021-5838 0618-501




